Способы трепанации черепа. Декомпрессивные операции при непрямом повреждении лицевого нерва. Повреждения черепных нервов
Также называемая «краниотомия», представляет собой разрез черепной коробки и удаление части кости (лоскута) черепа, которая вырезается с целью обеспечения доступа к мозгу. Операция может быть проведена разными способами, называющимися соответственно удаляемой части черепа.
Полное название процедуры, как правило, соответствует площади и сложности хирургического вмешательства. Небольшие разрезы размером с копейку носят название «краниотомии замочной скважины». Для проведения трепанации посредством миниатюрных отверстий применяются эндоскопические инструменты и визуализационные техники. Краниотомия замочной скважины в большинстве случаев проводится если необходимо:
- Вставить желудочковый шунт при гидроцефалии;
- Вставить глубокий стимулятор мозга в случае операции при паркинсонизме;
- Вставить монитор интракраниального давления;
- Провести патологической ткани мозга;
- Удалить кровяной сгусток;
- Вставить эндоскоп при операции аневризмы и опухолей мозга.
Трепанация больших по размеру лоскутов черепа носит название «хирургии основания черепной коробки». Такой вид краниотомии предполагает частичное удаление костной ткани, поддерживающей нижнюю часть мозга, где расположены тонкие черепные сосуды и нервы. Врачи применяют специализированные компьютерные программы для планирования и определения возможных последствий трепанации черепа, а также выявления поражений.
Ход операции трепанации черепа
Выполняется в 6 этапов. В зависимости от патологии и сложности ее лечения хирургическое вмешательство может длиться от трех до пяти часов.
Этап 1. Подготовка к операции
Пациент приезжает в клинику утром перед процедурой, натощак. Непосредственно перед хирургией через вену на руке вводится анестетик. После того, как пациент засыпает, его голова помещается в фиксирующее устройство, удерживающее ее в одном положении на протяжении всей операции.
Этап 2. Проводится разрез кожного покрова
Поверхность кожного покрова головы обрабатывается антисептическим препаратом и делается разрез за линией роста волос. Обычно перед такой процедурой бреется вся область предполагаемого разреза, но иногда используется щадящая техника бритья, при которой бреется лишь часть площади планируемого надреза.
Этап 3. Выполняется трепанация черепа
Кожа головы и мышцы отсоединяются от кости. Затем специальным инструментом проделывается одно или более небольшое отверстие в костной ткани. Вырезанная часть черепа поднимается и устанавливается обратно по завершении операции.
Этап 4. Операция на мозге
После открытия твердой оболочки мозга посредством хирургических ножниц врач открывает ткани в области, требующей лечения. Нейрохирурги в ходе операции используют специальные увеличивающие очки, называемые операционным микроскопом, который позволяет точно рассмотреть сосуды и нервы, тем самым максимально предотвращая возможные последствия трепанации черепа.
Этап 5. Исправление патологии
В связи с тем, что мозг закрыт внутри костей черепной коробки, его ткани нельзя легко переместить в сторону для получения доступа к патологии и устранения проблемы. Для этого используются миниатюрные инструменты, которыми можно манипулировать внутри мозга и не повреждать окружающие ткани ( , лазеры, УЗ-аспираторы, системы компьютерной визуализации с руководящими указаниями и др.). Для стимуляции определенных черепных нервов применяется специальный мониторинг, позволяющий контролировать реакции в головном мозге. Это дает возможность хирургу сохранить функцию нерва и убедиться, что он не поврежден. На данном этапе также можно убедиться, что операция трепанации черепа прошла без отрицательных последствий.
Этап 6. Закрытие отверстия черепа
После удаления опухоли или части мозга ткани возвращаются на место, и твердая оболочка зашивается. Удаленный лоскут кости возвращается в свое первоначальное положение и прикрепляется к черепу с помощью винтов и титановых пластин. При необходимости под кожу головы на несколько дней устанавливается дренажная трубка, позволяющая удалять скапливающуюся жидкость из хирургической области. После этого мышцы и кожа зашиваются, на место разреза накладывается мягкая повязка.
Послеоперационный период
После хирургического вмешательства пациента переводят в послеоперационную палату, где он приходит в себя от наркоза, а жизненно важные процессы контролируются медицинским персоналом. Дыхательная трубка, как правило, удаляется лишь после полного восстановления пациента, после чего он переводится в палату реанимации для дальнейшего наблюдения.
Онкологи центра, контролирующие состояние человека, периодически будут светить фонариком в глаза, и задавать вопросы относительно его состояния и пр. К последствиям трепанации черепа относится тошнота и головная боль, эти симптомы контролируются с помощью медицинских препаратов.
В зависимости от типа операции на головном мозге, могут быть назначены стероидные препараты (контролирующие отек мозга) и противосудорожные препараты. После стабилизации состояния пациента его переводят в обычную палату для полного восстановления.
Срок пребывания в клинике после краниотомии составляет от двух-трех дней до двух недель, в зависимости от сложности операции и наличия осложнений. Швы или скобы снимаются через семь-десять дней после операции.
Специалисты центра IBCC предлагают пациенту индивидуальный подход к его заболеванию и составляют каждому личный план лечения рака мозга.
Заполните форму и мы свяжемся с Вами в ближайшее время
Общепринятой тактикой лечения острых травматических внутричерепных гематом и очагов ушиба мозга является их ранняя диагностика и удаление до развития дислокации мозга и необратимых изменений в стволовых структурах мозга. Условиями для ревизии внутричерепных образований и радикального удаления всех очагов повреждения мозга являются: правильное расположение трепанационного окна по отношению к травматическому очагу и достаточная величина трепанационного отверстия. На выбор хирургом тактики и метода лечения (способа трепанации ) влияет большое число факторов: вид, объем, локализация внутричерепного травматического очага, наличие многооскольчатых переломов костей свода черепа, выраженность проявлений вторичных факторов повреждения мозга (отек, ишемия). Также немаловажное значение имеют оснащение стационара диагностическим оборудованием, традиции отделения и личный опыт хирурга.
Трепанация бывает резекционной, после которой в черепе остается отверстие, и костно-пластическая (КПТЧ), когда выпиленный костный лоскут укладывают на место, прикрывая им трепанационное окно. Если по каким-либо причинам костный лоскут сохранить невозможно (например, наличие вдавленного перелома в месте предполагаемой трепанации), то трепанационное отверстие закрывают инородным материалом (акриловыми пластмассами, медицинским цементом, металлической пластиной и др.). Такая трепанация называется аллопластической. Таким образом, при пластических операциях костный дефект в черепе закрыт. Отдельно выделяют декомпрессивную трепанацию черепа (ДТЧ), предложенную еще в 1905 г. Н.Cushing, целью которой является создание дополнительного резервного внутричерепного пространства при нарастающем отеке и пролабировании мозга или при большой вероятности развития этих процессов после удаления травматического очага . ДТЧ выполняют путем удаления фрагмента костей свода черепа, рассечения, а затем пластики твердой мозговой оболочки (ТМО). Резекционную трепанацию выполняют путем резекции кусачками или выпиливания костного лоскута из фрезевых отверстий пилой Джили и удалением его.
Различают одно- и двусторонние трепанации
черепа.
В зависимости от локализации травматического очага при планировании хирургического доступа выделяют трепанации:
в лобной области (односторонние фронтальные, бифронтальные) – для доступа к лобным долям и образованиям передней черепной ямки;
в височной области (темпоральные) – чаще всего производятся при черепно-мозговой травме (ЧМТ), для доступа к образованиям средней черепной ямки;
в лобно-височной области (фронтолатеральные, птериональные) – для одновременного доступа к образованиям передней и средней черепных ямок;
в лобно-височно-теменной области – используются при обширных очагах ушиба и размозжения мозга, для ревизии полюсно-базальных отделов лобной и височной долей; при необходимости из такого доступа можно выполнить декомпрессивную трепанацию;
в теменной области;
в затылочной области;
трепанация
задней черепной ямки – для доступа к субтенториальным очагам повреждения (медианная и парамедианная субокципитальные трепанации) .
Преимуществами КПТЧ являются: возможность сохранить собственную костную ткань для закрытия трепанационного дефекта, избежать в дальнейшем повторных краниопластических операций и развития «синдрома трепанированных». При применении КПТЧ отсутствует влияние внешнего атмосферного давления на вещество мозга, что приводит к более быстрому восстановлению мозгового кровообращения в ишемизированных тканях в послеоперационном периоде.
Проводимая в ходе операции одномоментная пластика костного дефекта значительно сокращает сроки временной нетрудоспособности и повышает качество жизни пациентов.
Техника выполнения КПТЧ.
Положение больного на операционном столе зависит от локализации внутричерепного очага повреждения. Как правило, трепанацию в лобной, височной и теменной областях производят в положении больного на спине; при трепанации в затылочной области или в области задней черепной ямки – на боку, животе или сидя. При положении на спине необходимо следить, чтобы голова больного была приподнята по отношению к туловищу на 10–15° и повернута от вертикальной линии в зависимости от задач хирургического доступа. Низкое положение головы затрудняет венозный отток из полости черепа, что может привести к повышению внутричерепного давления (ВЧД).
Линия кожного разреза должна быть сформирована с учетом формы, размера и локализации костного лоскута, а также в зависимости от хода основных сосудисто-нервных стволов кожных покровов. Для проецирования топографии долей, борозд и извилин головного мозга можно использовать различные схемы (Kronlein, Taylor-Haughton). Кровотечение из поврежденных кожных сосудов останавливают наложением кровоостанавливающих зажимов или с помощью специальных кожных клипс. КПТЧ можно выполнить путем выкраивания свободного костного лоскута, надкостнично-костного лоскута или костного лоскута на питающей мышечно-надкостничной ножке.
ТМО вскрывают дугообразным разрезом по периметру костного окна, отступив от него на 0,5–0,7 см. Разрез ТМО следует начинать в бессосудистой зоне. Коагуляцию кровоточащих сосудов ТМО проводят до ее вскрытия, так как после ее рассечения оболочка сморщивается, деформируется, что препятствует в дальнейшем ее герметичному зашиванию.
После проведения основного этапа операции (удаление гематомы, очагов ушиба и размозжения мозга) ТМО следует зашить герметично с целью профилактики послеоперационной раневой ликвореи, подкожных гигром и др. Для предупреждения образования послеоперационных эпидуральных гематом ТМО подшивают и подтягивают к надкостнице по периметру костного дефекта, а также в его центре.
С целью создания нормальных анатомических соотношений в ране при выполнении костно-пластической трепанации важным является этап фиксации костного лоскута. Костный лоскут необходимо фиксировать с помощью надкостничных или костных швов лавсаном, проволокой или абсорбирующимся шовным материалом (у детей), а также титановыми или пластиковыми краниофиксами. Следует помнить, что слабая фиксация костного лоскута может привести в послеоперационном периоде к его миграции, деформации черепа и как следствие к повторной операции.
Отек и ишемия головного мозга, приводящие к снижению церебрального перфузионного давления (ЦПД) и развитию внутричерепной гипертензии (ВГ), являются основными патофизиологическими процессами, ведущими к неблагоприятному исходу. Целью ДТЧ является увеличение внутричерепного объема, благодаря чему происходит снижение ВЧД, увеличивается уровень напряжения кислорода в мозговой ткани (РtiО2) и улучшается функциональное состояние мозга. Однако на практике не всегда удается прогнозировать развитие послеоперационного отека или эволюцию очагов ушиба мозга.
ДТЧ выполняется, как правило, в условиях нарастающего отека головного мозга, и она должна быть выполнена так, чтобы нивелировать условия ущемления мозга. Это достигается путем удаления костного лоскута, рассечения ТМО и выполнения ее свободной пластики.
Довольно часто встречаются неправильные определения трепанаций черепа, противоречащие смыслу оперативного вмешательства (например, «костно-пластическая декомпрессивная трепанация» или «костно-пластическая трепанация с отсроченной фиксацией костного лоскута»). Это дезориентирует нейрохирурга относительно правильной техники выполнения того или иного способа трепанации. Вместо истинной ДТЧ может быть выполнена пластическая трепанация, которая клинически желаемого декомпрессивного эффекта не дает, а в ряде случаев может и ухудшить состояние больного.
Иногда при выполнении ДТЧ хирурги не удаляют костный лоскут, а оставляют его в области операции, не фиксируя к краям дефекта и формируя так называемый вентиль или костный клапан. По замыслу авторов, после ликвидации отека мозга костный лоскут встает на место, закрывая тем самым окно в черепе. Но поскольку ДТЧ выполняется для снижения ВЧД, сохранение препятствий (кость, ТМО) противоречит цели операции и снижает ее эффективность. Подобные операции порочны.
Для предотвращения дислокации костного лоскута при выполнении костно-пластической трепанации
черепа необходима его прочная фиксация к костям черепа. Предпочтительно применять фиксацию металлическими краниофиксами или пластинами.
Резекционная трепанация
черепа не тождественна декомпрессивной. Если при резекционной трепанации черепа не рассекают ТМО, то декомпрессивного эффекта не будет. Декомпрессивная трепанация черепа невозможна без рассечения ТМО.
В зависимости от локализации трепанационного окна выделяют следующие виды ДТЧ:
в височной области (темпоральная и битемпоральная);
в лобной области (фронтальная и бифронтальная);
в лобно-височной области (одно- и двусторонняя);
в затылочной области (окципитальная).
ДТЧ может быть одно- и двусторонней. Отдельно выделяют краниоэктомию, гемикраниоэктомию и циркулярную краниотомию. При краниоэктомии резецируют обе гемисферы черепа так, что остается только полоска костной ткани над верхним сагиттальным синусом. Под гемикраниоэктомией подразумевают операцию, при которой резецируют практически всю гемисферу черепа с одной стороны. Циркулярную краниотомию производят путем выкусывания «дорожки» по наибольшему периметру черепа таким образом, что верхняя часть черепа становится подвижной по отношению к нижней. В настоящее время краниоэктомию, гемикраниоэктомию и циркулярную краниотомию практически не применяют ввиду их большой травматичности. Наиболее часто применяется подвисочная ДТЧ.
Правила выполнения ДТЧ
При выполнении ДТЧ необходимо выполнять ряд требований, отступление от которых снижает эффективность операции и приводит к осложнениям. Обязательным условием выполнения ДТЧ является большой размер костного дефекта. Размеры трепанационного окна не должны препятствовать свободному пролабированию мозга, пока сохраняется послеоперационный отек. Небольшой по размеру трепанационный дефект приводит к ущемлению в нем мозгового вещества, компрессии вен, ишемии и инфаркта ущемленного участка и как следствие к увеличению отека мозга. Кроме того, создаются условия для дополнительной травмы поврежденного мозга. Размер трепанационного окна оказывает значительное влияние на исход хирургического лечения. Так, у пациентов с размерами дефекта 12х15 см послеоперационная летальность на 20% ниже и на 15% больше хороших функциональных исходов, чем у больных с размером трепанационного окна 6х8 см .
Трепанационное окно накладывается ближе к месту крепления мозжечкового намета, так как декомпрессия, проведенная на уровне предполагаемого вклинения, способна предотвратить или максимально уменьшить эффект дислокации ствола мозга на уровне его ножек, кроме того, облегчается ревизия базальных отделов лобной и височной долей. Таким образом, трепанационное окно накладывают как можно ниже в височной области, с резекцией чешуи височной кости и большого крыла клиновидной кости на участке от наружного слухового прохода до лобно-скулового шва. Резекция бортика височной кости является обязательной при выполнении декомпрессивной трепанации
.
При хирургии острых внутричерепных гематомах или очагов ушиба и размозжения мозга декомпрессивный эффект операции в значительной мере зависит от локализации трепанации и ДТЧ может не дать желаемого эффекта, если из-за неточности диагностики она произведена вдали от травматического очага. При планировании размеров и локализации трепанационного дефекта необходимо учитывать данные компьютерной томографии (КТ) головного мозга. Правильно наложенное трепанационное окно позволяет произвести радикальное удаление очага повреждения и ревизию подоболочечного пространства.
Еще одним важным моментом при выполнении ДТЧ является правильное вскрытие ТМО. Она должна быть рассечена широким разрезом по всему периметру трепанационного дефекта с основанием, обращенным к основанию черепа так, чтобы сохранить питающие артериальные сосуды (a. meningea media).
Другие варианты разреза ТМО – крестообразный или Н-образный применять нецелесообразно, так как при таком разрезе площадь трепанационного окна уменьшается приблизительно на 1/3 (рис. 4, 5). Наиболее целесообразным представляется дугообразное вскрытие ТМО, при котором достигается наибольшая площадь декомпрессии .
Sкруга=pr2, Sквадрата=A2.
Например, при D=6 см Sкруга=28 см2, Sквадрата=18 см2;
еS=Sкруга–Sквадрата=10 см2=36%.
Типичной ошибкой при вскрытии ТМО во время ДТЧ является проведение разреза непосредственно по краю костного дефекта. В этом случае костный край трепанационного окна остается не прикрытым мягкими тканями, что создает условия для большей травмы вещества мозга при его интраоперационном отеке. Во избежание этих нежелательных осложнений ТМО следует вскрывать по периметру костного окна, отступив от него на 0,5–0,7 см. Кроме того, остающийся край ТМО можно использовать для подшивания к нему трансплантата при проведении свободной пластики ТМО (рис. 6).
После удаления гематомы, очагов ушиба и размозжения мозга как обязательный этап при ДТЧ должна применяться свободная пластика ТМО. Ее выполняют для создания достаточного объема при протрузии вещества головного мозга при условии надежного разобщения мозга и мягких тканей с целью предотвращения последующего спаечного процесса между головным мозгом и мягкими покровными тканями черепа.
Дефект в ТМО, как правило, замещают пластическим материалом. Наилучший результат дает применение протезов ТМО из современных синтетических материалов (например, политетрафторэтилен) или на основе обработанного коллагена. Применять в качестве пластических материалов мышцу, фасцию бедра, апоневроз, лиофилизированную трупную оболочку или вообще отказываться от выполнения пластики ТМО не следует, так как это способствует сращению мозга с аутотканями. Площадь протеза ТМО должна быть настолько большой, чтобы предотвратить контакт мозга с апоневрозом и образование мозговых рубцов. Это очень важно для профилактики возникновения эпилептических припадков в послеоперационном периоде и облегчает проведение последующей пластики дефекта черепа при реабилитации пострадавших.
После проведения свободной пластики ТМО височную мышцу и апоневроз подшивают одиночными узловыми швами по периметру костного дефекта. Апоневроз следует ушивать особенно тщательно, потому что именно он будет удерживать рану после снятия кожных швов при сохраняющемся пролабировании мозга в послеоперационном периоде.
Следствием и главным недостатком ДТЧ являются дефекты черепа, приводящие к формированию грубого оболочечно-мозгового рубца, травматической эпилепсии и энцефалопатии, нарушению крово- и ликворообращения. Кроме того, в условиях отека, при значительном пролабировании вещества мозга в трепанационный дефект, имеется риск расхождения краев послеоперационной раны с формированием раневой ликвореи, пролапса мозга и последующим развитием гнойно-воспалительных осложнений. В позднем послеоперационном периоде костный дефект, приводящий к деформации черепа, вызывает у пациентов психологический дискомфорт, а также повышается риск повторной травмы мозга.
Выбор метода трепанации черепа
Отношение к декомпрессивной и костно-пластической трепанации черепа менялось с течением времени и появлением новых технологий в диагностике и лечении тяжелой ЧМТ.
До применения современных способов нейровизуализации, при хирургическом лечении пострадавших с ЧМТ в подавляющем большинстве случаев отдавали предпочтение ДТЧ, считая ее необходимым компонентом операции при удалении внутричерепной гематомы. ДТЧ часто выполняли с профилактической целью – увеличить объем полости черепа в случае возможного прогрессирования отека мозга в послеоперационном периоде.
По мере накопления клинического опыта было отмечено, что в группах больных с КПТЧ и ДТЧ результаты хирургического лечения практически не отличаются между собой, а способ краниотомии существенного влияния на исход не оказывает.
С введением в практику КТ, магнитно-резонансной томографии (МРТ) и способов измерения ВЧД показания к применению ДТЧ значительно сузились.
Чаще всего вопрос выбора метода трепанации черепа встает перед хирургом при лечении пострадавших, находящихся в коматозном состоянии с повреждениями большого объема. К сожалению, на практике приходится сталкиваться с недостаточным оснащением стационаров современной диагностической аппаратурой, отсутствием возможностей для проведения мультимодального нейромониторинга. Тогда приходится ориентироваться на данные клинико-неврологического осмотра и КТ головного мозга, а в ряде случаев – только на клиническую картину пострадавших.
Показания к проведению костно-пластической и декомпрессивной трепанации черепа
До 80-х годов XX века при оперативном лечении больных с тяжелой ЧМТ в подавляющем большинстве случаев применялась ДТЧ. Как правило, ДТЧ выполняли с профилактической целью – увеличить объем полости черепа в случае возможного прогрессирования отека головного мозга в послеоперационном периоде, хотя отек развивался не во всех случаях. С течением времени постепенно наметилась тенденция применять тот или иной метод трепанации черепа в зависимости от интраоперационного состояния вещества мозга. Было отмечено, что проведение костно-пластической трепанации черепа в остром периоде ЧМТ позволяет значительно сократить сроки временной нетрудоспособности, а отдаленные результаты хирургического лечения пациентов в значительной степени определяются тяжестью ЧМТ, объемом оперативного вмешательства и в меньшей степени зависят от способа трепанации.
В настоящее время оптимальным способом трепанации черепа считается костно-пластическая. Сторонники костно-пластической трепанации советуют применять ее даже больным в тяжелом состоянии независимо от вида очага повреждения.
Костно-пластическая трепанация, как правило, применяется при одиночных внутричерепных гематомах конвекситального расположения и малого объема, когда исключается возможность развития острого отека вещества головного мозга в послеоперационном периоде. Критерием выбора служит компенсированное состояние больных: сохранность сознания, стабильные показатели сердечно-сосудистой и дыхательной систем, начальные стадии развития дислокационного синдрома.
ДТЧ производят при интраоперационном пролабировании вещества мозга, его нарастающем отеке и дислокации, при большой вероятности развития этих процессов после удаления больших (более 100 см3) травматических субдуральных и внутримозговых гематом, при наличии массивных участков ушиба и размозжения мозга и особенно при их сочетаниях – патологии, провоцирующей бурное развитие отека мозга с последующей дислокацией и сдавлением его ствола. Также рекомендуется применять декомпрессивную трепанацию при обширных очагах размозжения вещества мозга с наличием масс-эффекта, располагающихся в полюсах лобной и височной долей. Одним из решающих факторов при выборе декомпрессивной трепанации является наличие в клинической картине дыхательных и гемодинамических расстройств, что является признаками поздних стадий дислокационного синдрома – мезенцефальной и стадии моста.
Проведение ДТЧ можно считать обоснованным при стойком повышении ВЧД до уровня 35–40 мм рт. ст. на срок от 30 мин до 48 ч, рефрактерном к консервативной терапии.
Нецелесообразно проведение ДТЧ при первичном поражении ствола головного мозга .
С целью определения оптимального метода трепанации черепа при тяжелой ЧМТ в НИИ скорой помощи им. Н.В.Склифосовского проведено проспективное рандомизированное исследование 73 пациентов, которым проводили хирургическое лечение по поводу ЧМТ. Проведено сравнение группы пациентов, которым выполняли ДТЧ или КПТЧ. Группы сравнивали по полу, возрасту, времени от момента травмы до операции, уровню сознания перед операцией, объему очага повреждения, величине латеральной дислокации, степени аксиальной дислокации. Достоверных различий по этим параметрам нами не выявлено (p>0,05). Условия включения пострадавших в исследование были выработаны на основании ретроспективного анализа результатов хирургического лечения 1082 пострадавших с ЧМТ. Также провели оценку результатов мониторинга ВЧД во время операции и в послеоперационном периоде.
Выделены факторы риска, оказывавшие влияние на исход хирургического лечения пострадавших в группах: клинические – возраст пациентов, степень бодрствовния перед операцией и данные нейровизуализации – объем повреждения, величина латеральной и степень аксиальной дислокации, величина 2-го вентрикулокраниального коэффициента (ВКК-2).
Анализируя динамику изменений ВЧД в течение оперативного вмешательства и в послеоперационном периоде пострадавших, которым проводили удаление травматического внутричерепного очага, мы выделили 3 типа изменений давления.
При первом типе отмечали значительное снижение ВЧД во время операции независимо от исходного уровня. Максимальное снижение ВЧД до нормального уровня было на этапе удаления гематомы. К концу операции ВЧД не превышало критического уровня (20 мм рт. ст.). У всех пострадавших в последующие сутки происходил его небольшой подъем, но ко 2-м суткам уровень ВЧД несколько снижался и не превышал нормального значения.
Для 2-го типа было характерно снижение ВЧД до нормального уровня в конце операции и значительная тенденция к увеличению в первые 2 сут после оперативного вмешательства.
При 3-м типе максимальное снижение ВЧД отмечено на этапе удаления гематомы, но к концу операции уровень ВЧД значительно превышал нормальные значения и сохранялся высоким в последующее время.
Проведенное исследование показало отсутствие достоверной разницы в исходах хирургического лечения у пострадавших с КПТЧ и ДТЧ, проспективно отобранных в группы по заданным параметрам. Еще раз подчеркиваем, что наше исследование проведено для пострадавших, интраоперационное состояние мозга которых позволяло выполнить КПТЧ. Нами не получено убедительных данных о неодинаковом воздействии внечерепных и внутричерепных факторов в исследуемых группах .
Проведенные исследования позволили нам дать рекомендации по выполнению ДТЧ:
1. Неуправляемая методами интенсивной терапии ВГ в совокупности с клинической картиной пострадавшего и данными КТ головного мозга (уровень ВЧД в послеоперационном периоде более 40 мм рт. ст., поздние стадии развития дислокационного синдрома с нарушением витальных функций, диффузный отек головного мозга с признаками грубой аксиальной дислокации).
2. Интраоперационные проявления отека и набухания головного мозга.
3. Наличие множественных внутричерепных повреждений (сочетания субдуральных, внутримозговых гематом и очагов ушиба мозга) с одновременным уменьшением величины ВКК-2, по данным КТ головного мозга, менее 8% у больных молодого возраста (до 50 лет).
4. II или III тип динамики ВЧД.
Литература
1. Cushing H. Subtemporal decompressive operation for the intracranial complications associated with bursting fractures of the skull. Ann Surg 1908; 47.
2. Лебедев В.В., Крылов В.В. Неотложная нейрохирургия: Руководство для врачей. М.: Медицина, 2000.
3. Лебедев В.В., Крылов В.В., Ткачев В.В. Декомпрессивная трепанация черепа. Нейрохирургия. 1998; 2: 38–43.
4. Jiang JY, Xu W, Li WP. Efficacy of standard trauma craniotomy for refractory intracranial hypertension with severe traumatic brain injury: a multicenter, prospective, randomized controlled study. J Neurotrauma 2005; 22: 623–8.
5. Guerra WK, Gaab MR, Dietz H et. al. Surgical decompression for traumatic brain swelling: indications and results. J Neurosurg 1999; 90: 187–96.
6. Guidelines for the management of severe traumatic brain injury. Brain Trauma Foundation, American Association of Neurological Surgions, Joint Sections on Neurotrauma and Critical Care. J Neurotrauma 2000; 17: 451–627.
7. Polin RS, Shaffrey ME, Bogaev CA et al. Decompressive bifrontal craniectomy in the treatment of severe refractory posttraumatic cerebral edema. Neurosurgery 1997; 41: 84–92; discussion 92–94.
8. Крылов В.В., Талыпов А.Э., Пурас Ю.В. Внутричерепное давление при повреждениях головного мозга. Нейрохирургия. 2007; 4: 12–9.
9. Пурас Ю.В., Талыпов А.Э., Крылов В.В. Критерии выбора способов трепанации черепа у пострадавших с тяжелой черепно-мозговой травмой. Мед. катастроф. 2008; 1: 32–8.
Журнал Хирургия №1. 2009 год.
ГЛАВА 4. МЕТОДИКИ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА НА ЧЕРЕПЕ И ПОЗВОНОЧНИКЕГЛАВА 4. МЕТОДИКИ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА НА ЧЕРЕПЕ И ПОЗВОНОЧНИКЕ
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К НЕЙРОХИРУРГИЧЕСКОЙ ОПЕРАЦИИ
Все нейрохирургические вмешательства подразделяют на экстренные и плановые.
Под экстренными вмешательствами понимают те операции, которые требуют незамедлительного их выполнения для спасения жизни больного. Для проведения этих операций применяют необходимый минимум диагностических мероприятий.
Плановые нейрохирургические операции предполагают полный комплекс обследований, подготовку больного к операции и использование в ходе неё самых современных технических и тактических приёмов. Как правило, эти операции характеризуются радикальностью выполнения, широким использованием микрохирургических приёмов, меньшим числом осложнений и летальных исходов.
Показания к нейрохирургическому оперативному вмешательству подразделяют на абсолютные и относительные.
Абсолютные показания
К абсолютным показаниям относят все наблюдения, при которых существует угроза жизни больного в ближайший период при поступлении больного в стационар. Этими показаниями могут быть: внутричерепные гематомы, дислокационный синдром при опухолевой, сосудистой патологии, разрывы аневризм в первые 2 сут от момента разрыва, огнестрельные повреждения, выпадения грыжи диска с компрессией спинного мозга и его сосудов и другие.
Относительные показания
К относительным показаниям относят все те наблюдения, при которых заболевание само по себе не опасно для жизни, но по истече-
нии какого-то времени его осложнения могут привести к инвалидизации больного или даже к его гибели. Примером таких заболеваний могут быть аневризмы сосудов головного мозга, опухоли головного мозга, ликворные свищи с рецидивирующим менингоэнцефалитом и другие. Сюда же относят заболевания, не опасные для жизни, даже с учётом осложнений, но проявляющиеся неврологическими симптомами, излечимыми только хирургическим путём. Это могут быть дефекты костей черепа, повреждения периферических нервов, грыжи межпозвонковых дисков с нарушениями спинно-мозгового кровообращения и другие. Относительными показаниями к операции служат заболевания, основное проявление которых - боль. Например, невралгия тройничного нерва, туннельные невропатии и другие.
Принятие решения о назначении операции зависит от многих факторов: сложности операции, взаимоотношения с сосудами, подкорковыми структурами, стволом, функционального состояния головного мозга, обширности поражения, возраста больного, возможностей развития инфекций в послеоперационном периоде, а также ожидаемого результата оперативного вмешательства.
Операции выполняют под общим обезболиванием.
В случае близости патологического процесса к важным вегетативным центрам, участвующим в регуляции кровообращения, дыхания, обмена веществ и ряда других функций, основой профилактики расстройств жизненно важных функций наряду с нейровегетативной блокадой, заместительной терапией глюкокортикоидами служит атравматичное, физиологически дозволенное с использованием микрохирургических приёмов и увеличительной оптики оперативное вмешательство. В последние годы используют адекватное анестезиологическое пособие, которое предполагает применение нейролептоаналгезии или фентанилклофелинового наркоза при постоянном клинико-физиологическом мониторинге. Всё это улучшило контроль состояния больного на всех этапах оперативного вмешательства и позволило значительно повысить результативность лечения.
Абсолютные противопоказания
К абсолютным противопоказаниям для операции в нейрохирургии относят ситуации, при которых риск вмешательства превышает ожидаемые результаты как в плане жизни, так и глубокой инвалидизации. Например, считают нецелесообразным оперировать больного,
у которого выявлены множественные метастазы как при удалённом, так и неудалённом первичном очаге. Не следует планировать проведение операции, которая сохраняла бы жизнь больного на непродолжительный период при развитии у него в послеоперационном периоде гемиплегии, тотальной афазии или слепоты. Сюда же относят наблюдения, когда хирурги не уверены, что продлят жизнь больного на более значительный срок, чем он проживёт без операции.
В нейрохирургии, так же как и в хирургии, вообще все оперативные вмешательства подразделяют на радикальные, при которых объёмное образование удаляют полностью, и оперативные вмешательства с частичным его удалением. В тех случаях, когда основное заболевание неизлечимо, но для продления жизни больного достаточно ликвидировать гипертензионно-гидроцефальный синдром, в нейрохирургии применяют ликворошунтирующие вмешательства - паллиативные операции.
В нейрохирургии широко используют реконструктивные операции на периферических нервах, сосудах, синусах, костях черепа и позвоночнике.
С 1947 г. производят стереотаксические операции, предложенные Spitgel, Wycis, Marks и Lee.
С 70-х годов ХХ в. в нейрохирургии внедрены микроскоп и микрохирургическая техника, позволившие добиться блестящих успехов, значительного снижения летальности и увеличения радикальности хирургических вмешательств.
ВИДЫ КРАНИОТОМИЙ
Вне зависимости от характера поражения мозга первоначально необходимо обеспечить к нему доступ путём вскрытия черепа или позвоночного канала.
В современной нейрохирургии существуют два метода трепанации костей свода черепа - резекционный и костно-пластический.
Резекционная трепанация
Резекционную трепанацию производят при наличии показаний к декомпрессии и в процессе первичной хирургической обработки проникающего черепно-мозгового ранения. Кость при этом удаляют на протяжении, необходимом для достижения поставленной цели.
Удаление кости осуществляют двумя способами. При одном из них кость, лишённую надкостницы, резецируют кусачками из наложенного фрезевого отверстия. Этот метод носит название резекционного. Иногда данный способ применяют для удаления участков черепа с внутрикостным ростом опухоли.
При другой разновидности этого способа выпиливают костный лоскут, который отделяют от мягких тканей (надкостницы, мышц) и затем удаляют (рис. 4-1, см. цв. вклейку). В настоящее время такой вид трепанации называют костно-пластической декомпрессивной трепанацией.
Костно-пластическая трепанация
При костно-пластической трепанации выкраивают кожно-апоневротический лоскут, затем образуют костно-надкостничный или костно-надкостнично-мышечный лоскут, которые откидывают в сторону на время манипуляций в полости черепа, а после окончания операции укладывают на место.
Трепанации черепа производят как в плановом, так и экстренном порядке. Перед операцией бреют голову, после этого кожу головы обрабатывают этиловым спиртом и накладывают повязку, смоченную 70% этиловым спиртом. На операционном столе кожу головы дважды обрабатывают спиртом, затем йодом. В настоящее время в связи с появлением новых антисептических растворов кожу головы обрабатывают этими растворами.
Обезболивание включает общее и местное - 0,5% раствором новокаина, которым инфильтрируют всю зону оперативного вмешательства, выполняя при этом также гидравлическую препаровку тканей.
В зависимости от места операции больной лежит на боку или на спине с приподнятой на 10-15° головой, что несколько уменьшает застойные явления в сосудах головы и кровопотерю. При некоторых локализациях внутричерепной патологии применяют полусидячее положение.
Краниотомия при супратенториальном расположении патологического процесса
При доступе к лобной, височной, теменной и затылочной долям применяют следующую методику. Вначале выкраивают и откидывают в сторону большой кожно-апоневротический лоскут на широком основании. При выкраивании лоскута обращают внимание на
сохранность артериальных сосудов, питающих лоскут. Необходимо, чтобы питание лоскута осуществлялось двумя, а ещё лучше тремя артериальными сосудами. В случае экстренного оперативного вмешательства используют вертикальный или подковообразный разрез кожи в височно-теменной области по Кушингу (1905) (рис. 4-2). При этих доступах края раны разводят в стороны. Кровотечение из сосудов кожи останавливают накладыванием зажимов или скобок Мишеля, которые удаляют в конце операции перед наложением кожных швов. Рассечение надкостницы осуществляют электроножом соответственно предполагаемому костно-надкостничному лоскуту. Разрезы в области височной мышцы должны сопровождаться хорошим гемостазом кровоточащих сосудов с помощью коагуляции. Распатором скелетируют кость по линии рассечения надкостницы на ширину
Рис. 4-2. Резекционная подвисочная трепанация по Кушингу: а - выполняют резекцию кости из фрезевого отверстия; б - образуют трепанационное отверстие и обнажают твердую мозговую оболочку; в - вскрывают твёрдую мозговую оболочку; г - послойно зашивают рану; 1 - лоскут надкостницы; 2 - кость; 3 - твёрдая оболочка
наносимых в последующем фрезевых отверстий. Обычно образовывают 4-6-9 фрезевых отверстий, которые соединяют между собой пропилами, оставляя неповреждённой питающую ножку мышечно-надкостничного лоскута. Некоторые нейрохирурги питающую ножку не оставляют. Для пропилов используют проводник Поленова и пилу Джильи. После образования костно-надкостничного лоскута его откидывают с помощью двух элеваторов (лопаточки Буяльского) в сторону и фиксируют к белью с помощью специальных крючков или лигатур. В настоящее время для выпиливания костно-надкостничного лоскута используют электроили пневматические трепаны. Их применение значительно облегчает и ускоряет этот этап оперативного вмешательства. При поднятии костно-надкостничного лоскута в нижних отделах височной кости может произойти повреждение средней оболочечной артерии в месте её выхода из костного канала. Если обрыв артерии не произошёл, то с помощью электрокоагуляции производят выключение этой артерии у места вхождения в костный канал. При случившемся повреждении артерии в костном канале производят её «замазывание» в нём с помощью воска. При необходимости расширения трепанационного отверстия в нижние отделы височной области дополнительно резецируют височную кость к основанию средней черепной ямки. Размеры трепанационного окна обычно достигают 6-7x8-9 см. После обнажения твёрдой мозговой оболочки её лучше рассекать П-образно основанием к верхнему сагиттальному синусу с дополнительными насечками книзу и в стороны. Обращают особое внимание на тщательную остановку кровотечения из сосудов оболочки. Недостаточный гемостаз сосудов может повлечь за собой образование в послеоперационном периоде эпи- и субдуральных гематом в области раны (рис. 4-3).
Рассечение твёрдой мозговой оболочки лучше производить после предварительного введения под её предполагаемый разрез мозгового шпателя. Появляющееся и с трудом останавливаемое кровотечение из эпидурального пространства прекращают подшиванием оболочки к надкостнице. Кровотечение из диплоических вен и эмиссарных выпускников должно быть остановлено промазыванием их воском. Наложение зажимов на сосуды твёрдой мозговой оболочки и их перевязку в нейрохирургии практически не используют. При наличии внутричерепной гипертензии для уменьшения значительного напряжения твёрдой мозговой оболочки и выраженной протрузии мозга, возникшей после её рассечения, показано внутривенное введение
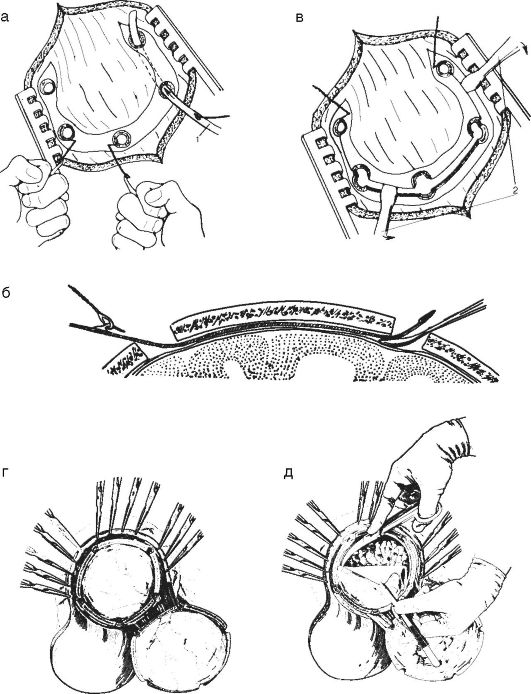 Рис. 4-3.
Костно-пластическая
трепанация черепа: а, б - после выкраивания кожно-апоневротического
лоскута накладывают фрезевые отверстия, между костью и твердой оболочкой
проводят проводник с крючком, на котором надета петля проволочной пилы
Джигли; в - после выпиливания откидывают костно-пластический лоскут; г, д
- затем вскрывают твердую оболочку и обнажают кору головного мозга; 1 -
проводник; 2 - элеваторы
Рис. 4-3.
Костно-пластическая
трепанация черепа: а, б - после выкраивания кожно-апоневротического
лоскута накладывают фрезевые отверстия, между костью и твердой оболочкой
проводят проводник с крючком, на котором надета петля проволочной пилы
Джигли; в - после выпиливания откидывают костно-пластический лоскут; г, д
- затем вскрывают твердую оболочку и обнажают кору головного мозга; 1 -
проводник; 2 - элеваторы
фуросемида от 40 до 60 мг. В особо тяжёлых случаях, при высокой внутричерепной гипертензии, за 1 ч до операции внутривенно вводят маннитол из расчёта 1-2 г/кг. Можно производить вентрикулярную разгрузочную пункцию переднего или заднего рога бокового желудочка в типичных местах с медленным выведением спинно-мозговой жидкости. При неосложнённом течении хирургического вмешательства твёрдая мозговая оболочка должна быть зашита наглухо. В случаях сохраняющейся внутричерепной гипертензии, при некоторых локализациях опухолей, в остром периоде черепно-мозговых травм, остром периоде разрыва артериальных аневризм, при злокачественных глиомах, выраженном отёке-набухании головного мозга твёрдую мозговую оболочку не зашивают, а дефект в ней прикрывают гемостатической губкой или в него вшивают свободный участок апоневроза, надкостницы или участок лиофилизированной твёрдой мозговой оболочки. Костный лоскут укладывают на место и фиксируют швами за надкостницу. При продолжающемся отёке-набухании головного мозга в конце операции может быть произведено удаление костного лоскута с его сохранением для последующей пластики дефекта, о чём будет сказано ниже. Наружная декомпрессия мозга может быть создана не только за счёт удаления костного лоскута, но также дополнена резекцией нижних отделов костного лоскута. Кожную рану ушивают послойно, последовательно, с предварительной остановкой кровотечения из крупных сосудов с помощью биполярной коагуляции. В мозговую рану при необходимости устанавливают трубку или мягкие резиновые выпускники. Под кожно-апоневротический лоскут также заводят резиновый выпускник. Выпускники и трубки удаляют через 1-3 сут после операции, поэтапно подтягивая их при каждой перевязке.
Краниотомия задней черепной ямки
Положение больного на операционном столе - лёжа на животе лицом вниз. При невозможности придать такую позу больному показано положение на боку. Благоприятные условия для уменьшения венозного кровотечения возникают при положении сидя.
Доступ в заднюю черепную ямку применяют для удаления опухолей, локализующихся в ней, при черепно-мозговой травме и для вмешательства на сосудах вертебрально-базилярного бассейна. Наиболее широко распространён доступ, предложенный в 1926 г. Фразье и Тауном, а затем в 1928 г. Наффцигером (рис. 4-4). В последующем доступ был усовер-
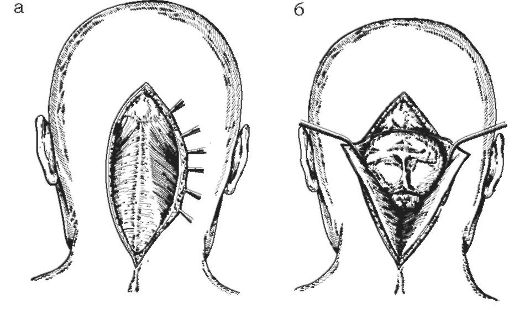
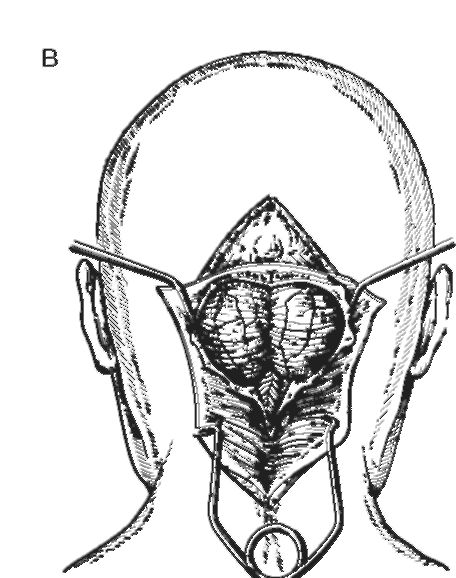 Рис. 4-4.
Вскрытие
задней черепной ямки срединным разрезом по Наффцигеру: а - разрезают
кожу; б - рассекают мышечно-апоневротический слой и обнажают чешую
затылочной кости и заднюю дужку атланта; в - выполняют резекцию чешуи
затылочной кости и задней дужки атланта, вскрывают твёрдую мозговую
оболочку и обнажают заднюю поверхность мозжечка
Рис. 4-4.
Вскрытие
задней черепной ямки срединным разрезом по Наффцигеру: а - разрезают
кожу; б - рассекают мышечно-апоневротический слой и обнажают чешую
затылочной кости и заднюю дужку атланта; в - выполняют резекцию чешуи
затылочной кости и задней дужки атланта, вскрывают твёрдую мозговую
оболочку и обнажают заднюю поверхность мозжечка
шенствован И.С. Бабчиным. Разрез проводят по линии остистых отростков от V шейного позвонка вверх в затылочную область на 4 см выше наружного затылочного бугра. Поверхностные мягкие ткани отсепаровывают от глубокой фасции широко в стороны. Выкраивают полуромб из мышц шеи, вершина которого обращена к большому затылочному отверстию. Скелетируют затылочную кость и дугу атланта, которые затем частично резецируют. Твёрдую мозговую оболочку рассекают V- образно вершиной к атлантозатылочному сочленению. После удаления патологического образования задней черепной ямки разрез твёрдой мозговой оболочки не зашивают. Дефект в ней прикрывают апоневрозом, лиофилизированной твёрдой мозговой оболочкой или гемостатической губкой. Накладывают швы на мышцы, апоневроз, кожу.
Хороший доступ к структурам задней черепной ямки возникает при арбалетном разрезе по Кушингу (рис. 4-5) или подковообразном разрезе.
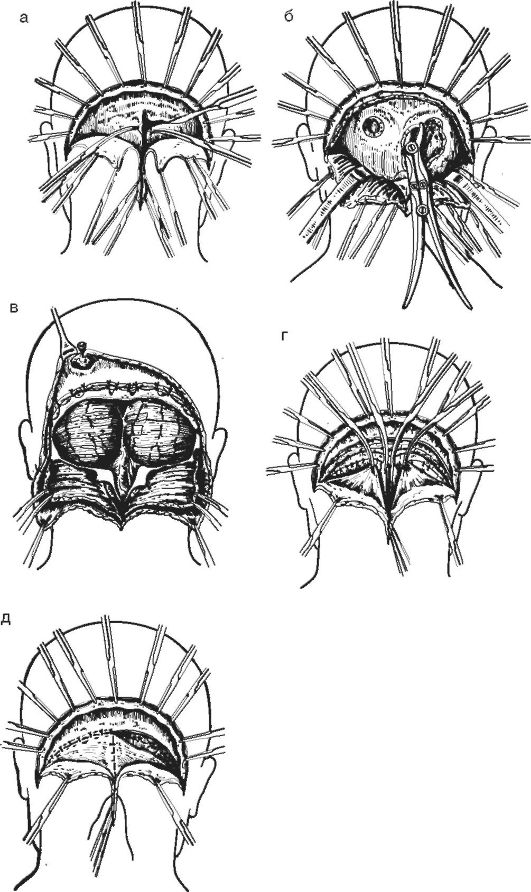 Рис. 4-5.
Вскрытие
задней черепной ямки арбалетным разрезом по Кушингу: а - разрезают кожу
и мышечно-апоневротический слой; б - расширяют фрезевые отверстия на
чешуе затылочной кости, удаляют заднюю дужку атланта; в - выполняют
вентрикулярную пункцию, вскрывают твердую мозговую оболочку, обнажают
полушария мозжечка; г, д - зашивают мягкие ткани наглухо
Рис. 4-5.
Вскрытие
задней черепной ямки арбалетным разрезом по Кушингу: а - разрезают кожу
и мышечно-апоневротический слой; б - расширяют фрезевые отверстия на
чешуе затылочной кости, удаляют заднюю дужку атланта; в - выполняют
вентрикулярную пункцию, вскрывают твердую мозговую оболочку, обнажают
полушария мозжечка; г, д - зашивают мягкие ткани наглухо
Принципы выполнения мозговой части оперативного вмешательства
Внедрение в клиническую практику в 70-х годах ХХ в. микроскопа и микрохирургической техники, усовершенствование хирургической тактики и техники выполнения оперативных вмешательств, улучшение технического оснащения и совершенствование анестезиологического обеспечения операций позволили значительно улучшить результаты хирургических вмешательств. При некоторой нейрохирургической патологии летальность в ведущих клиниках мира в настоящее время отсутствует. Достижение этих результатов оказалось возможным при учёте следующих весьма важных положений. Во-первых, одно из условий успешного проведения операций - защита важных в функциональном отношении зон мозга и его сосудов от операционных травм. Во-вторых, хирургическая тактика зависит от особенностей локализации патологического процесса, от соотношения с сосудами и важными в функциональном отношении зонами головного мозга, а также от степени компенсации нарушений артериального и венозного церебрального кровотока.
В-третьих, от технической оснащённости при выполнении оперативного вмешательства. Защита функционально важных стволовых структур во время операции предполагает не только современное комплексное анестезиологическое пособие, но также применение системы модифицированных хирургических мероприятий, включающих тактику, широкое применение увеличительной оптики и микрохирургию. Весьма важна физиологичность разрезов мягких тканей, сохранение путей оттока крови от головного мозга. При выполнении мозгового этапа оперативного вмешательства необходимо щадящее отношение не только к артериальным сосудам, но также и к венозным, особенно в случае магистрального типа их строения.
С этой целью необходимо обязательное применение микрохирургического инструментария, увеличительных луп (2,5-6 крат), а также операционного микроскопа, что позволит с большой вероятностью атравматично производить выделение и отделение сосудов от опухолей, их мобилизацию из мозга. Сохранение как крупных, так и мелких сосудов предотвращает появление в послеоперационном периоде ишемических поражений головного мозга, сопровождающихся грубыми очаговыми неврологическими симптомами. Перед выполне-
нием каких-либо манипуляций на мозге хирург не должен спешить, а чётко представить себе область мозга, на которой он будет производить манипуляции. Определить взаимоотношение этой области с другими участками головного мозга. Ни в коем случае нельзя производить рассечение мозга в функционально значимых участках, поскольку в послеоперационном периоде у таких больных будут грубые неврологические выпадения. Доступ к этим областям следует осуществлять через зоны, повреждение которых не будет сопровождаться появлением грубых очаговых неврологических симптомов. Так, например, доступ к опухоли левой височной доли у правшей может происходить через её полюс или базальные отделы (рис. 4-6). Объём оперативного вмешательства зависит от состояния больного во время операции, кровопотери, состояния гемодинамики, а также данных электрофизиологического контроля. При появлении нарушений со стороны этих показателей необходимо хирургическое вмешательство остановить на время и оценить создавшуюся ситуацию. В случае регресса патологических реакций операцию можно продолжить. При отсутствии положительной динамики показателей вмешательство следует закончить и отложить на следующий этап, сроки выполнения которого будут зависеть от степени компенсаторных возможностей организма больного.
Кровотечение во время оперативного вмешательства при разрезе мягких тканей может быть остановлено простым прижатием пальцами краёв раны к костям черепа. Кровотечение из сосудов твёрдой мозговой оболочки останавливают коагуляцией (лучше биполярной), клипированием, которое в настоящее время нейрохирурги применяют довольно редко из-за опасности развития
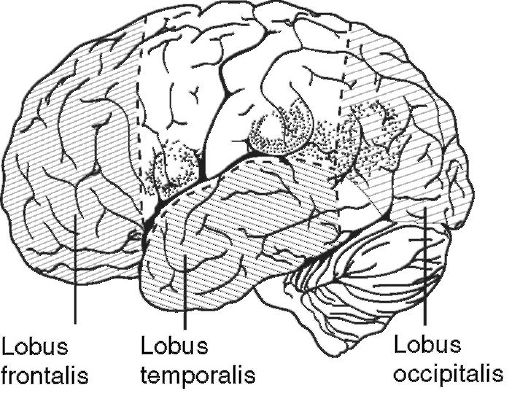 Рис. 4-6.
Наружная
поверхность левого полушария. Заштрихованы зоны коры мозга, при
повреждении или удалении которых не будут развиваться паралич
конечностей или моторная афазия
Рис. 4-6.
Наружная
поверхность левого полушария. Заштрихованы зоны коры мозга, при
повреждении или удалении которых не будут развиваться паралич
конечностей или моторная афазия
эпилептических припадков, а также невозможности проведения в послеоперационном периоде МРТ. Кровотечение из средней оболочечной артерии, повреждённой в костном канале, следует останавливать медицинским воском. Общепринятая методика по остановке кровотечения из паренхимы головного мозга - использование гемостатической губки, гемостатической плёнки и реже биполярной коагуляции. Кровоточащие небольшого диаметра артериальные и венозные сосуды обычно подвергаются биполярной коагуляции. В настоящее время кровотечение из функционально важных сосудов диаметром более одного миллиметра останавливают наложением швов, восстанавливающих просвет сосуда, что выполняют под микроскопом при увеличении в 7,5-15 крат с помощью нитей 10-11/00.
Оперативное вмешательство обычно заканчивают наложением швов на твёрдую мозговую оболочку, что позволяет восстановить герметичность субдурального пространства. Однако в случае острых внутричерепных гематом, после удаления абсцессов мозга, больших оболочечных опухолей, частичного удаления внутримозговых новообразований, при протрузии мозга в операционную рану или его коллапсе, что бывает после удаления хронических внутричерепных гематом, в остром периоде разрыва артериальных аневризм, огнестрельных ранениях, базально расположенных опухолях мозга зашивание твёрдой мозговой оболочки нецелесообразно из-за развития и нарастания отёка мозга в послеоперационном периоде с последующей дислокацией и ущемлением ствола. Несвоевременная диагностика этого осложнения чревата гибелью больных или при своевременной диагностике повторной операцией с удалением костного лоскута и снятием швов с твёрдой мозговой оболочки для создания декомпрессии. В некоторых случаях при отсутствии угрозы нарастания отёка головного мозга в дефект твёрдой мозговой оболочки вшивают участок апоневроза, надкостницы или лиофинизированной твёрдой мозговой оболочки. Костный дефект обычно закрывают костно-надкостничным лоскутом, образованным в начале операции. В случаях сохраняющегося или возникшего во время операции отёка мозга, обусловленного вышеперечисленными ситуациями, костный лоскут может быть удалён, после чего накладывают швы на надкостнично-апоневротические лоскуты и кожу. Обычно под кожный лоскут вводят 1 или 2 резиновых выпускника для оттока раневого отделяемого.
СТЕРЕОТАКСИЧЕСКАЯ НЕЙРОХИРУРГИЯ
Стереотаксис (стереотаксический метод) обеспечивает малотравматичный прицельный доступ к различным, в том числе и глубоким, образованиям мозга и локальные воздействия на них.
Появление стереотаксического метода обычно связывают с работами российского анатома Д.Н. Зернова, который в 1889 г. предложил прибор энцефалометр.
В 1906 г. английские исследователи Кларк и Хорсли создали стереотаксический метод для лабораторных животных. Для попадания инструментом в заранее предназначенную точку мозга ими разработаны стереотаксический аппарат, содержащий систему координат, и первые стереотаксические карты мозга экспериментальных животных. Ими же предложен термин «стереотаксис» (от греческого «стереос» - пространство, «таксис» - расположение, порядок). Применение стереотаксиса в клинике для вмешательств с целью диагностики и лечения больных людей началось благодаря работам американских неврологов Шпигеля и Вайсиса (1947).
Приёмы стереотаксиса можно условно разделить на две части: стереотаксическое наведение и стереотаксические воздействия. Основа стереотаксического наведения - геометрия, метод координат. Стереотаксическое наведение включает определение положения стереотаксических мишеней в пространстве и нацеливание на них стереотаксического инструмента.
Метод координат позволяет выразить в числах пространственное положение точек относительно какой-либо системы координат. В стереотаксисе используют несколько типов системы координат. Прямоугольная система координат - три взаимно перпендикулярные плоскости, называемые координатными плоскостями. Точка пересечения координатных плоскостей - начало координат. Линии пересечения координатных плоскостей - оси системы координат - называют латинскими буквами x, y, z. Положение любой точки в прямоугольной системе координат задаётся тремя числами - тремя координатами точки (тремя расстояниями точки до координатных плоскостей). В полярной системе координат положение точки задаёт- ся тремя числами - одним расстоянием (длина радиуса-вектора) и
двумя углами. При постоянной длине радиуса-вектора полярная система координат превращается в экваториальную систему координат.
Любая стереотаксическая методика содержит несколько систем координат.
Система координат мозга
В клиническом стереотаксисе прямоугольная система координат мозга строится по внутримозговым ориентирам, чаще всего используют переднюю и заднюю коммиссуры мозга. Ось х проходит через центры коммиссур от затылка ко лбу, начало координат 0 - середина расстояния между коммиссурами, ось z проходит от базальных отделов мозга к темени, ось y слева направо (рис. 4-7).
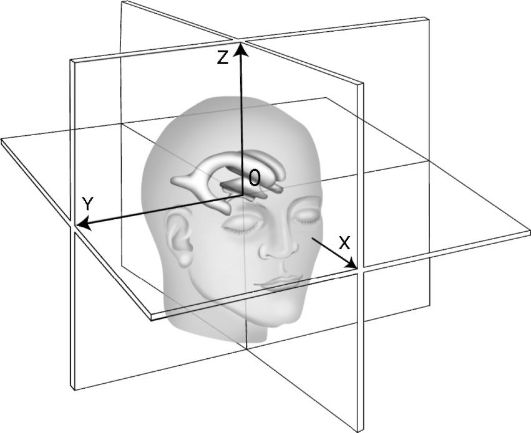 Рис. 4-7.
Система координат мозга (объяснение в тексте)
Рис. 4-7.
Система координат мозга (объяснение в тексте)
Система координат стереотаксического атласа
Стереотаксический атлас - обычно набор фотографий срезов мозга с изображениями мозговых структур, плоскости срезов строго параллельны координатным плоскостям системы координат. Правила построения системы координат стереотаксического атласа и системы координат мозга аналогичны. Это позволяет измерять в атласе координаты целевых точек и переносить их в системы координат мозга.
Система координат стереотаксического аппарата
Стереотаксические аппараты - устройства для прицельного введения в мозг пациента стереотаксического инструмента - моделируют
в своей конструкции одну или две системы координат. Современные аппараты обычно содержат прямоугольную и экваториальную систему координат.
Система координат локализатора
Систему координат локализатора, так же как систему координат стереотаксического аппарата, относят к инструментальным системам координат. Локализаторы - устройства, которые фиксируются на голове пациента и содержат в своей конструкции модель прямоугольной системы координат. Различают рентгеновские локализаторы, КТ-локализаторы, МРТ-локализаторы, ПЭТ-локализаторы. Они позволяют определять координаты объекта по его рентгеновскому, КТ-, МРТ-, ПЭТ-изображению (рис. 4-8).
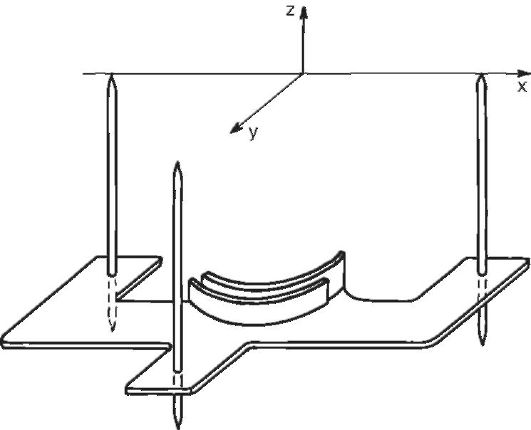 Рис. 4-8.
Локализатор
Рис. 4-8.
Локализатор
Стереотаксическая интроскопия
Для определения пространственного положения внутримозговых образований в клинике используют стереотаксическую контрастную рентгенографию (пневмоэнцефалографию, вентрикулографию, ангиографию), КТ, МРТ и ПЭТ. Основное и главное отличие стереотаксического исследования (интроскопия) от обычного диагностического заключается в том, что стереотаксис всегда требует количественной оценки изображения, возможности его измерения для последующих расчётов пространственного положения точек, внутримозговых образований или деталей технических устройств. На плёнках или компьютерных томограммах должны присутствовать изображения дета-
лей, моделирующих систему координат стереотаксического аппарата или локализатора. Специальная прикладная научная дисциплина - вычислительная рентгенограмметрия - создана для использования рентгеновского изображения в стереотаксисе. Расчётная стереотаксическая МРТ - самый современный вид стереотаксической интроскопии. Она даёт наиболее детальную картину внутримозгового пространства, атравматична и безвредна, обеспечивает минимальные ошибки в определении пространственного положения стереотаксических мишеней.
Преобразование стереотаксических координат - перевод координат целевой точки (стереотаксической мишени) из одной системы координат в другую. Поскольку каждая стереотаксическая методика включает несколько систем координат, приходится производить последовательно несколько преобразований одной и той же точки в разные системы координат. Например, из системы координат стереотаксического атласа в системы координат мозга и далее в системы координат рентгеновского локализатора, прямоугольную систему координат стереотаксического аппарата и, наконец, в экваториальную систему координат стереотаксического аппарата. После этого возможно прицельное погружение стереотаксического инструмента в мозг.
В клиническом стереотаксисе используют три способа преобразования координат:
С помощью вычислений (аналитический способ); в современном стереотаксисе вычисления производят с использованием компьютера;
С помощью геометрических построений; такие построения могут быть произведены на плоскостях рентгеновских плёнок или экране томографа;
С помощью фантомного моделирования; стереотаксический фантом - устройство, предназначенное для моделирования в пространстве системы координат и целевых точек.
Стереотаксические расчёты - обязательный этап каждой стереотаксической методики. Его проводят после этапа интроскопии или одновременно с ним. Его суть заключается в построении системы координат, определении их взаимного пространственного положения и преобразовании координат целевых точек в системы координат стереотаксического аппарата.
Контактные и дистантные стереотаксические воздействия
Все возможные виды стереотаксических воздействий можно разделить на две группы:
Контактные воздействия, требующие введения стереотаксического инструмента в мозг; их осуществляют с помощью интрацеребральных электродов, криозондов, биопсийных игл и т.д.; их главный недостаток - необходимость хирургического вмешательства, однако именно такие воздействия и такие инструменты составляют подавляющее большинство всех воздействий и инструментов, принятых в клиническом стереотаксисе;
Дистантные воздействия, не требующие погружения в мозг; они могут быть бескровными, и это важнейшее их достоинство, однако ограниченный характер воздействий, очень высокая стоимость и одномоментность применения существенно сужают возможности применения дистантных воздействий.
Наиболее широко известные аппараты дистантного воздействия предназначены только для локальных разрушений ткани. Например, разработанный Лекселлом γ-нож (фирма Электа, Швеция) содержит более двухсот источников γ-излучения, направленных в одну точку пространства. В процессе стереотаксического наведения зону мозга, намеченную к разрушению, совмещают с этой точкой. Другой пример - сфокусированный пучок протонов, исходящий из мощного ускорителя (например, ускоритель Санкт-Петербургского института ядерной физики). Голова больного в специальном устройстве располагается так, чтобы протонный пучок проходил через зону мозга, намеченную к разрушению. При этом голова вращается вокруг указанной зоны. Эта зона разрушения получает максимальную радиационную нагрузку, а покровные ткани головы гораздо меньшую. γ-Нож и протонный пучок в основном используют для разрушения небольших опухолей, лечения АВМ.
Стереотаксические инструменты для контактных воздействий - устройства, прицельно погружаемые в мозг для осуществления локальных дозированных воздействий.
Долгосрочные электроды - тонкие, гибкие, обычно изготавливаемые из благородных металлов или неокисляющихся сплавов, покрытые биологически инертной изоляцией. Обычно электроды имплантируют в виде пучков по 4 или 6 электродов в пучке; диаметр каждого электрода - 0,1 мм; длина контактной, лишённой изоляции поверхности каждого электрода - около 1 мм. Поскольку электродные пучки гибкие, их прицельное введение производят с помощью
тонкой металлической трубки (иглы-направителя). После погружения направитель удаляют, а пучок фиксируют к костным краям фрезевого отверстия. Электроды могут оставаться в мозгу пациента до нескольких месяцев. Долгосрочные электроды позволяют регистрировать электрокортикограмму и электросубкортикограмму, электрические потенциалы нейронных групп, вызванные потенциалы, а также проводить стимуляции электрическими импульсами, электрополяризации (временные выключения структур мозга током малой продолжительности и силы), электролизисы (воздействия большей продолжительности и силы для лечебных локальных деструкций нервной ткани).
Электроды для интраоперационного контроля и воздействий - жёсткие, круглого сечения, диаметр - около 2 мм. Такой электрод может иметь одну или несколько контактных поверхностей и использоваться для регистрации кортикограммы и субкортикограммы, проведения диагностических электрических стимуляций и лечебных деструкций. Деструкцию проводят с использованием переменного тока высокой частоты. В результате этого воздействия нервная ткань нагревается и разрушается. Такой способ называют диатермокоагуляцией.
Криозонд (криохирургический аппарат) - устройство для локальной интраоперационной деструкции нервной ткани путём её замораживания. Криодеструкцию считают наиболее физиологичным методом выключения нервной ткани, она реже других методов даёт такие осложнения, как внутримозговое кровотечение. Криозонд - устройство круглого сечения с закруглённым концом, диаметр - 2-3 мм. В рабочем конце криозонда расположена активная камера, в которую подаётся хладоагент. По всей своей длине, кроме активной камеры, криозонд снабжён тепловой защитой чаще всего в виде вакуумированного пространства. В качестве хладоагента могут быть использованы сжиженные газы (жидкий азот), сжатые газы (азот), легкоиспаряющиеся жидкости (закись азота), твёрдая углекислота (температура -78°С) с ацетоном. В последнем случае ацетон под давлением поступает в активную камеру, охлаждает её и затем удаляется. Такой криохирургический аппарат при наличии термодатчика в активной камере позволяет управлять процессом охлаждения, в частности, проводить диагностическое обратимое охлаждение нервной ткани и в случае необходимости экстренно прекращать процесс замораживания.
Разработаны инструменты для стереотаксической биопсии, с помощью которых можно брать кусочки ткани для гистологического исследования (биоптаты).
Стереотаксические системы - промышленно выпускаемые комплексы приборов, инструментов и компьютерных программ, предназначенные для проведения стереотаксических вмешательств. Наиболее известные зарубежные стереотаксические системы: Лекселла фирмы Электа (Швеция), Рихерта-Мундингера фирмы Фишер (Германия), БРВ фирмы Радионикс (США) и др.
Стереотаксическая система «Поаник». Эта отечественная компьютеризированная стереотаксическая система разработана лабораторией стереотаксических методов Института мозга человека РАН и ГНЦ РФ ЦНИИ «Электроприбор» (рис. 4-9). Важное достоинство ПОАНИК - атравматичная маркировка головы больного с помощью оттиска зубов пациента. При каждом прикусывании пациентом своего оттиска зубы верхней челюсти погружаются в соответствующие углубления оттиска, который занимает относительно черепа и мозга одно и то же пространственное положение. На оттиске могут быть поочерёдно зафиксированы локализаторы для рентгенографии, КТ, МРТ и ПЭТ. Благодаря этому возможно проведение интроскопии заблаговременно до операции без травмирования больного. Эта система позволяет проводить стереотаксические операции в нейрохирургических отделениях, которые не имеют собственного томографа, а интроскопическая подготовка может быть выполнена на томографе, географически удалённом от операционной.
Функциональная и нефункциональная стереотаксия
Функциональная стереотаксия - наведение и воздействие на ядра и проводящие пути головного мозга для диагностики и лечения сложных хронических заболеваний центральной нервной системы, таких, как паркинсонизм, органические гиперкинезы, эпилепсия, неукротимые боли, некоторые психические расстройства.
Стереотаксические воздействия, используемые в функциональной стереотаксии, можно разделить на три
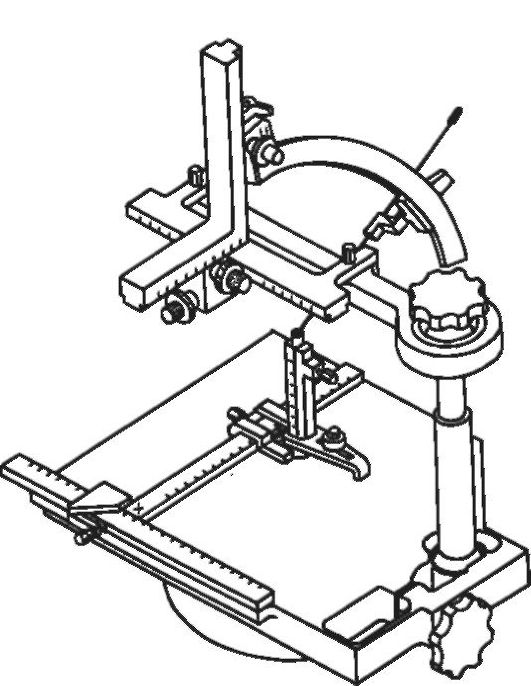 Рис. 4-9.
Стереотаксическая система «Поаник».
Рис. 4-9.
Стереотаксическая система «Поаник».
группы. Первая, наиболее часто применяемая, - локальные необратимые разрушения структур-мишеней. Разрушению могут быть подвергнуты те структуры, которые служат очагами патологической гиперактивности, вызывающей характерные для данного заболевания клинические проявления, например эпилептический очаг. Однако гораздо чаще локальному разрушению подвергаются морфологически и биохимически интактные структуры, которые в мозгу служат проводниками патологической активности. Вторая группа - временные, обратимые воздействия. Они более щадящие, более «физиологичные». Например, обратимые холодовые выключения структур с помощью локального охлаждения до -10°С или диагностические и лечебные электрические стимуляции. Последние, в зависимости от параметров (частота, сила тока, экспозиция), могут вызывать функциональную активацию структуры или, наоборот, её дисфункцию. Третья группа - трансплантация тканей, например аутотрансплантация тканей надпочечников или трансплантация эмбриональной ткани.
Выделяют четыре основных направления в функциональной стереотаксии:
Стереотаксия двигательных нарушений;
Стереотаксия боли;
Стереотаксия эпилепсии;
Стереотаксическая психохирургия.
СТЕРЕОТАКСИЯ ДВИГАТЕЛЬНЫХ НАРУШЕНИЙ
Стереотаксис можно использовать при ряде заболеваний с двигательными нарушениями:
Болезнь Паркинсона и паркинсонизм;
Посттравматические гиперкинезы (гемигиперкинезы);
Деформирующая мышечная (торсионная) дистония;
Эссенциальный тремор;
Хорея Хантингтона;
Детский церебральный паралич.
У больных с болезнью Паркинсона и паркинсонизмом могут быть использованы три основных вида воздействий:
Стереотаксическая трансплантация эмбриональной ткани, содержащей дофаминергические нейроны, которые трансплантируют в головки хвостатых ядер (однако этот вид трансплантации пока используют редко);
Стереотаксическая имплантация долгосрочных электродов для проведения лечебных электрических стимуляций; при этом могут использоваться миниатюрные вживляемые под кожу стимуляторы;
Локальные стереотаксические деструкции, которые применяют чаще других методов.
Стереотаксическими мишенями у больных с двигательными нарушениями могут быть ядра таламуса: вентролатеральный комплекс, срединный центр таламуса, медиальный членик бледного шара, субталамическая зона.
Вентролатеральный комплекс включает три ядра. Разрушение их приводит к снижению выраженности паркинсонических проявлений в конечностях контралатеральной (по отношению к оперируемой гемисфере) стороны (рис. 4-10). К этим ядрам относят:
Вентрооральное переднее ядро (оно имеет отношение к снижению мышечной ригидности);
Вентрооральное заднее ядро (его разрушение приводит к устранению гиперкинезов);
Вентральное интермедианное ядро (наружное и внутреннее); его разрушают, чтобы избавиться от тремора (причём тремора не только паркинсонического) в конечностях, в первую очередь в руках.
Срединный центр таламуса - его деструкция снижает выраженность паркинсонических проявлений и в большей степени ригидности; эта мишень менее эффективна, чем ядра вентролатерального комплекса, но в отличие от них позволяет повлиять и на ипсилатеральную сторону.
Медиальный членик бледного шара - его деструкция, особенно в области, прилежащей к лентикулярной петле, снижает мышечную ригидность, тремор и брадикинезию, прежде всего в контралатеральной ноге.
Субталамическая зона (поля Фореля) - эффективная стереотаксическая мишень у больных с двигательны-
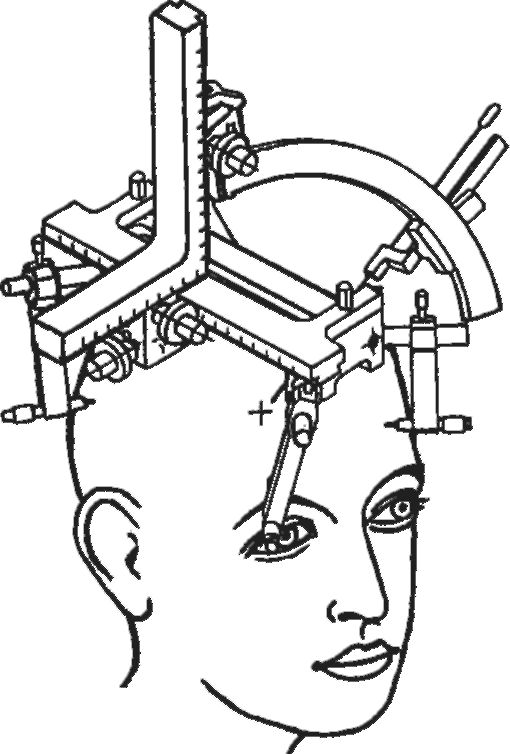 Рис. 4-10.
Прицельное погружение стереотаксического инструмента в мозговые мишени
Рис. 4-10.
Прицельное погружение стереотаксического инструмента в мозговые мишени
ми нарушениями (ригидность, в меньшей степени тремор), но требующая большей осторожности и точности попадания, чем ядра таламуса.
Перечисленные мишени могут быть использованы не только для лечения паркинсонизма, но и аналогичных двигательных нарушений при других нозологиях. Например, для стереотаксического лечения эссенциального тремора, гиперкинетической формы так называемого детского церебрального паралича и др.
СТЕРЕОТАКСИЧЕСКАЯ ПСИХОХИРУРГИЯ
Стереотаксис успешно применяют для коррекции целого ряда психопатологических расстройств. При этом его используют для трансплантации тканей эмбрионального мозга, электрических диагностических и лечебных стимуляций. Однако, как и в других разделах функциональной стереотаксии, подавляющее большинство воздействий - локальные деструкции.
В психохирургии используют следующие стереотаксические мишени:
Поясные извилины: наиболее частая мишень при лечении обсессивно-компульсивных расстройств, депрессий, алкоголизма, тревожности, неукротимых болей; наркомании;
Передние отделы внутренней капсулы; деструкцию проводят при лечении депрессий, навязчивых расстройств;
Миндалевидный комплекс; основная мишень при лечении агрессивности, эпилепсии, гораздо реже - гиперсексуальности;
Ядра таламуса (медиальные, интраламинарные, срединная пластинка); их деструкцию проводят при депрессии, кататоническом возбуждении, агрессии, обсессивно-компульсивных расстройствах, тревожности, тиках;
Субкаудатная область; деструкция показана у больных с обсессивными расстройствами, тревожностью, при депрессии и аффективных расстройствах;
Безымянная субстанция (ядро Мейнерта); его деструкция применяется прежде всего при депрессивных состояниях.
СТЕРЕОТАКСИЯ БОЛИ
Стереотаксис может быть применён для хирургического лечения неукротимых болей различного генеза, в частности при фантомном
болевом синдроме. В качестве лечебных воздействий используют электрические стимуляции через долгосрочные электроды, но чаще - локальные деструкции. К стереотаксическим мишеням для ликвидации неукротимых болей относят:
Таламические ядра - вентрокаудальное внутреннее ядро, срединный центр, медиальный отдел подушки;
Поясные извилины.
СТЕРЕОТАКСИЧЕСКОЕ
ЛЕЧЕНИЕ ЭПИЛЕПСИИ
При лечении эпилепсии применяют перечисленные выше способы воздействия: трансплантацию тканей эмбрионального мозга и значительно чаще - электрические стимуляции и локальные деструкции. Одним из ведущих диагностических методов при эпилепсии остаётся скальповая ЭЭГ. Данные, получаемые с её помощью, должны быть подкреплены другими электрофизиологическими исследованиями, в частности диагностическими электрическими стимуляциями, производимыми при кортико-субкортикографии. Известно, что в эпилептизированной структуре мозга стимуляция вызывает характерный ответ, так называемый послеразряд. В связи с этим значительную часть стереотаксической операции может занимать прицельная имплантация в мозг электродов. При данной методике электрофизиологические исследования могут производиться как в процессе операции, так и в послеоперационном периоде через электроды, введённые в мозг. При стереотаксическом лечении эпилепсии существуют два подхода. Первый - одномоментный, более предпочтительный, состоит в локализации очага и его разрушении. Если это невозможно из-за расположения очага в околостволовых структурах мозга или при неустановленных очагах, применяют второй подход - двухэтапный, при котором сначала диагностируют очаги, а затем, спустя 2-3 нед, производят второй этап операции - разрушение очагов. Чаще всего стереотаксис применяют для диагностики и лечения височных форм эпилепсии, поскольку гиппокамп и миндалевидный комплекс имеют самые низкие пороги судорожной готовности и именно в этих структурах, чаще чем в других, локализуются эпилептические очаги.
НЕФУНКЦИОНАЛЬНАЯ СТЕРЕОТАКСИЯ
Наведение на опухоли мозга, инородные тела, гематомы, абсцессы. Сюда входят: биопсия опухолей, пункция абсцессов с их дренированием, промыванием полости абсцесса растворами антибиотиков и при необходимости - осмотр стенок полости с помощью стереотаксически введённого эндоскопа, эвакуация гематом, стереотаксическое удаление инородных тел. К нефункциональной стереотаксии можно отнести также нейронавигацию. Эту технологию используют во время открытых нейрохирургических операций. Задача нейронавигации состоит в том, чтобы с помощью луча лазера низкой интенсивности или после стереотаксически введённого тонкого катетера указать нейрохирургу путь к небольшой глубоко расположенной опухоли или другому патологическому очагу.
КРИОХИРУРГИЧЕСКИЙ МЕТОД В НЕЙРОХИРУРГИИ
Криохирургия - метод лечения, при котором для получения лечебного эффекта используют низкие температуры.
При замораживании клеток любой ткани происходит образование кристаллов льда первоначально во внеклеточном пространстве, а затем внутри клетки. Первый процесс начинается при температуре среды около -5-10°С, а для второго необходимо снижение температуры до -20°С и ниже. Внеклеточное образование кристаллов льда приводит к уменьшению содержания воды в межклеточном пространстве, вследствие чего увеличивается концентрация электролитов вне клетки. Из-за появления градиента осмотического давления молекулы воды диффундируют через клеточную мембрану в межклеточное пространство, приводя к дегидратации клетки, увеличению внутриклеточного содержания электролитов, изменению рН. При этом выходят из строя механизмы активного транспорта. Этот феномен назвали «осмотическим шоком». Последующее охлаждение приводит к разрушению клеточных мембран и внутриклеточных структур образующимися кристалликами льда. Состояние, при котором прекращается движение цитоплазмы в охлаждённой клетке и возникает связанное с этим угнетение внутриклеточного метаболизма, получило название «терминальный шок». При криодеструкции выделено три зоны криовоздействия по мере отдаления от зонда: первая - зона крионекроза,
вторая - зона некробиоза с резко выраженными дистрофическими изменениями опухолевых клеток, третья - краевая зона опухоли, характеризуется умеренным периваскулярным и перицеллюлярным отёком ткани, с наличием небольших участков некробиоза.
С помощью криохирургии возможно производить разрушение и удаление опухолевой ткани открытым путём. Данная методика может быть использована для стереотаксического разрушения небольших новообразований, глубинных мозговых мишеней при лечении паркинсонизма, гиперкинезов, болевых синдромов и височной эпилепсии.
МЕТОДИКИ ЗАКРЫТИЯ ДЕФЕКТОВ ЧЕРЕПА
Первое детальное описание пластики трепанационного дефекта золотой пластинкой относят к 1565 г., оно было выполнено Петронием. С тех пор для краниопластики использовали различные материалы, в частности ауто-, гомо- и гетерогенные костные трансплантаты, костную стружку, металлы и акрилаты. Основные требования, предъявляемые к применяемому для краниопластики материалу, следующие: тканевая толерантность, простая техника приготовления, низкая температурная проводимость, прочность, рентгенопозитивность и малая стоимость.
В настоящее время используют две методики краниопластики: остеопластическую реконструкцию (аутоили гомогенным костным трансплантатом) и аллопластическую имплантацию индифферентных для организма протезов-эксплантатов. Применяют методику, предполагающую хранение выпиленного костного лоскута в 0,25-0,5% растворе формалина*, а также метод замораживания с последующей стерилизацией в автоклаве перед закрытием костного дефекта тому же пациенту. В 1923 г. Пфемистер предложил методику стерилизации костного лоскута его кипячением в течение 40 мин - 1 ч с последующей имплантацией лоскута на место трепанации. Экспериментальные и клинические исследования показали, что аутотрансплантаты, независимо от жизнеспособности пластического материала и методов его консервации, оказывают на репаративный процесс остеогенеза более выраженное стимулирующее воздействие, чем аллотрансплантаты. В качестве аллотрансплантатов применяют пластмассы: стиракрил, протакрил или металл - титан.
Техника операции
Разрез мягких тканей выполняют по старому послеоперационному рубцу. При невозможности его использования разрез делают с учётом сохранения кровоснабжения костного лоскута. Разрез надкостницы лучше производить, отступив от края костного дефекта кнаружи на 1-1,5 см. При возможности разделяют надкостнично-оболочечноапоневротический лоскут на две части продольно. Нижний лоскут отделяют от краёв костного дефекта. Моделируют аллотрансплантат по форме костного дефекта, после чего трансплантат фиксируют лигатурами к его краям. Сверху на трансплантат накладывают наружный листок разделённого лоскута, сшивают его края. Выпускники под кожно-апоневротический лоскут лучше не вводить.
ТЕХНИКА ЛАМИНЭКТОМИИ
Для подхода к спинному мозгу используют вскрытие позвоночного канала путём ламинэктомии, которую выполняют под наркозом. Положение больного на операционном столе - на животе или на боку. Необходимый уровень ламинэктомии определяют отсчётом от анатомических ориентиров: основание черепа в области заднего края большого отверстия затылочной кости, VII шейный позвонок (его остистый отросток не смещается при наклонах головы кзади), нижние углы лопаток, XII ребро, линия, соединяющая верхние ости или гребни подвздошных костей (IV и V поясничные позвонки) и I крестцовый позвонок. Уровень предстоящей ламинэктомии может быть уточнён посредством предварительно произведённой рентгенографии с контрастной зафиксированной меткой. Линию кожного разреза намечают с помощью 1% раствора метиленового синего*. Размеры операционного поля устанавливают с таким расчётом, чтобы кожный разрез был проведён на один позвонок выше и ниже позвонков, подлежащих ламинэктомии. Линейный кожный разрез при ламинэктомии производят по линии остистых отростков или слегка отступив в сторону. Рассекают апоневроз, после чего скелетируют мышцы с каждой стороны остистых отростков (рис. 4-11), а пространство между мышцами и каждой стороной остистого отростка тампонируют марлевыми салфетками на 3-5 мин. После извлечения салфеток останавливают кровотечение из мышц. Щипцами Листона резецируют остистые отростки как можно ближе к их основанию (рис. 4-12). Затем при-
 Рис. 4-11.
Скелетирование
остистых отростков и дужек позвонков: а - рассекают апоневроз; б -
выполняют скелетирование боковых поверхностей остистых отростков и дужек
позвонков с помощью распатора; 1 - тампонада марлей для гемостаза; Г-4"
- последовательность положения распатора
Рис. 4-11.
Скелетирование
остистых отростков и дужек позвонков: а - рассекают апоневроз; б -
выполняют скелетирование боковых поверхностей остистых отростков и дужек
позвонков с помощью распатора; 1 - тампонада марлей для гемостаза; Г-4"
- последовательность положения распатора
ступают к резекции дужек из междужковых пространств щипцами Борхардта или ламинэктомом. Обычно резецируют участок дужки, равный 2-3 см. Резекцию дужек шейных позвонков следует производить до суставных отростков. Дальнейшее их удаление, особенно на уровне шейного отдела, опасно из-за возможного ранения позвоночной артерии (на уровне С 2 -С 5) или спинно-мозгового корешка. Число удаляемых дужек от 2 до 4-5, но не более, что зависит от характера и размеров патологического процесса. В последние годы в связи с наличием микроинструментария для нейрохирургических вмешательств нередко операции на структурах позвоночного канала (например, удаление грыжи диска) проводят при гемиламинэктомии. После удаления дужек в рану предлежит эпидуральная клетчатка с проходящи-
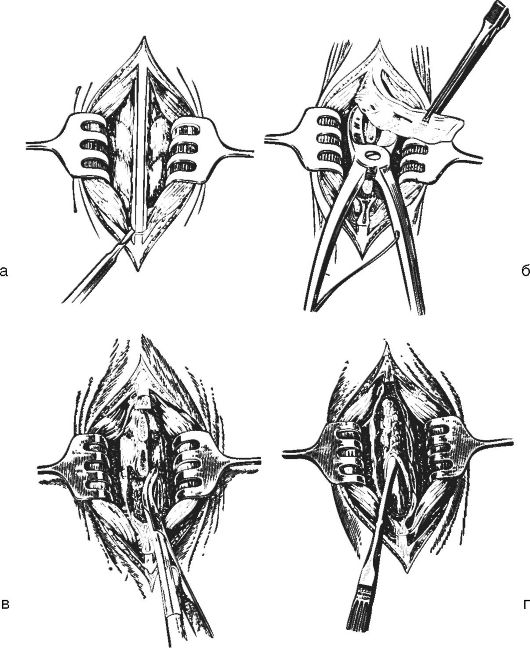 Рис. 4-12.
Ламинэктомия:
а - вскрывают мягкие ткани и обнажают боковые поверхности остистых
отростков и дужек позвонков; б - удаляют блок остистых отростков
кусачками Листона; в - удаляют участки дужек позвонков для расширения
доступа в позвоночный канал; г - отделяют эпидуральную клетчатку от
твердой мозговой оболочки и рассекают её
Рис. 4-12.
Ламинэктомия:
а - вскрывают мягкие ткани и обнажают боковые поверхности остистых
отростков и дужек позвонков; б - удаляют блок остистых отростков
кусачками Листона; в - удаляют участки дужек позвонков для расширения
доступа в позвоночный канал; г - отделяют эпидуральную клетчатку от
твердой мозговой оболочки и рассекают её
ми венами. При повреждении этих вен может начаться значительное венозное кровотечение. При операции на шейном отделе в этом случае существует опасность воздушной эмболии. В связи с этим в случаях повреждения эпидуральных вен желательна лёгкая тампонада эпиду-
рального пространства марлевыми полосками. Неизменённая твёрдая мозговая оболочка обычно сероватого цвета. При отсутствии в ней патологических изменений и образований под ней она эластичная и хорошо передаёт пульсацию спинного мозга. Разрез твёрдой мозговой оболочки проводят по средней линии почти до верхнего и нижнего углов операционной раны. Оба края рассечённой оболочки лигатурами подшивают к мышцам своей стороны или берут лигатуры на держалки, что позволяет расширить разрез оболочки. Подлежащую паутинную оболочку рассекают микроножницами или разрывают с помощью диссектора. Осматривают заднюю, боковые, а после рассечения зубовидных связок, фиксирующих спинной мозг к твёрдой мозговой оболочке, и переднюю его поверхность. Для мобилизации спинного мозга в грудном отделе иногда приходится пересекать 1-2 спинно-мозговых корешка с одной стороны. Оперативное вмешательство в большинстве случаев заканчивают зашиванием твёрдой мозговой оболочки и наложением послойных швов на рану. В последние годы стали применять костно-пластическую методику ламинэктомии. Эту методику используют в основном при выполнении плановых оперативных вмешательств.
Показаниями к операции на мозге могут быть различные заболевания: опухоли, аневризмы сосудов мозга, внутримозговые гематомы, травматические повреждения черепа и мозга, уродства, некоторые паразитарные и воспалительные заболевания и ряд других.
Операции на черепе и мозге различаются в зависимости от характера доступа и степени радикальности хирургического вмешательства. Кроме того, они могут быть диагностическими и лечебными.
Хирургические доступы
Фрезевые отверстия. Небольшие отверстия в черепе, обычно диаметром 1,5–2 см, делают в основном для выполнения диагностических исследований: обнаружения интракраниальной гематомы при черепно мозговой травме, для пункции мозга с целью получения фрагмента патологической ткани для гистологического исследования или для пункции желудочков мозга.
Фрезевые отверстия накладываются в типичных местах через небольшие кожные разрезы. Для выполнения этой операции используются различные трепаны, наиболее распространенными являются механические, электро– и пневмотрепаны. Фрезы, с помощью которых накладываются отверстия в черепе, различаются по своему устройству и размеру. В отдельных случаях применяют так называемые корончатые фрезы, которыми выпиливают в костях черепа кружок, который после завершения операции может быть уложен на место.
Краниотомия (трепанация черепа). Различают резекционную и костно пластическую трепанацию черепа.
Резекционная трепанация– заключается в удалении участка черепа. С этой целью накладывается фрезевое отверстие, которое затем расширяется с помощью костных кусачек до нужных размеров. Резекционная трепанация обычно производится с целью декомпрессии мозга при черепно мозговой травме, если внутричерепное давление резко повышено, или при многооскольчатом переломе, не позволяющем сохранить целостность кости. Кроме того, к резекционной трепанации прибегают при операциях на задней черепной ямке. Резекция кости в этой области технически проще, чем костно пластическая трепанация. При этом мощный слой затылочных мышц надежно защищает структуры задней черепной ямки от возможных повреждений, а сохранение кости в этих случаях не столь важно, как при операциях на полушариях большого мозга при супратенториальных процессах.
Костно пластическая трепанация заключается в формировании костного лоскута нужной конфигурации и размера, который после завершения операции укладывается на место и фиксируется швами. Место трепанации черепа определяется локализацией патологического процесса. При выполнении трепанации хирург должен хорошо ориентироваться во взаимоотношении между черепом и основными анатомическими структурами мозга, в первую очередь такими, как латеральная (сильвиева) борозда, отделяющая височную долю от лобной, центральная (роландова) борозда, центральные извилины и др.
Существуют различные способы и схемы переноса проекции этих образований на череп. Одна из схем, употребляемых до настоящего времени, предложена Кренлейном. Для определения проекции сильвиевой борозды и роландовой борозды он предлагает следующий прием. Первоначально проводится базовая линия через внутренний слуховой проход и нижний край глазницы, затем через верхний край глазницы проводится вторая линия, параллельная первой. От середины скуловой кости восстанавливается перпендикуляр, точка пересечения которого с верхней горизонтальной линией является нижней точкой роландовой борозды, для определения направления которой определяется ее верхняя точка. Ей соответствует место пересечения перпендикуляра, проходящего через сосцевидный отросток, с конвекситальной поверхностью черепа. Биссектриса угла, образованного проекцией роландовой борозды и верхней горизонтальной линией, определяет положение сильвиевой борозды.
В зависимости от локализации процесса (опухоль, гематома, абсцесс и пр.), в связи с которым осуществляется трепанация, делаются кожные разрезы в соответствующей области. Наиболее часто используются подковообразные разрезы, обращенные к основанию черепа. Используются также и прямые разрезы. При нейрохирургических операциях в косметических целях применяют главным образом разрезы, располагающиеся в пределах волосистой части головы.
При разрезах в лобно височной области желательно сохранять основные стволы поверхностной височной артерии, располагающиеся кпереди от уха.
С помощью трепана по периметру формируемого костного лоскута накладывается несколько фрезевых отверстий (обычно 4–5). Важно, чтобы фрезевые отверстия располагались на некотором расстоянии от кожного разреза для предупреждения формирования грубых Рубцовых сращений. С помощью специального проводника под кость между соседними фрезевыми отверстиями проводится проволочная пила (Джигли) и кость распиливается по всему периметру. Чтобы избежать проваливания костного лоскута, кнаружи, распил кости делают под углом скосом
В области надкостнично мышечной «ножки» лоскута кость только подпиливается и затем переламывается при поднимании кости с помощью специальных костных подъемников.
В последнее время все чаще применяются специальные пневмо– и электротрепаны, позволяющие выпиливать костные лоскуты любой величины и конфигурации из одного фрезевого отверстия. Специальная лапка на конце краниотома отслаивает твердую мозговую оболочку от кости по мере его перемещения. Распил кости осуществляется тонкой быстро вращающейся фрезой.
Разрезы твердой мозговой оболочки могут быть разной конфигурации, в зависимости от величины и размера патологического процесса, к которому планируется доступ. Используются подковообразные, крестообразные и лоскутные разрезы.
По завершении операции, если позволяет состояние мозга, необходимо по возможности герметично зашить твердую мозговую оболочку узловыми или непрерывными швами.
В тех случаях, когда после операции имеется дефект твердой мозговой оболочки, его необходимо закрыть. С этой целью могут быть использованы специально обработанная трупная твердая мозговая оболочка, широкая фасция бедра, апоневроз или надкостница.
С целью остановки кровотечения из кости место распила и внутренняя поверхность костного лоскута обрабатываются хирургическим воском.
Для предупреждения эпидуральных послеоперационных гематом оболочка в нескольких местах по периметру костного отверстия подшивается к надкостнице швами.
Чтобы уменьшить риск послеоперационного скопления крови в операционной ране, костный лоскут на всем протяжении отделяют от надкостницы и мышцы и в течение операции сохраняют в изотоническом растворе хлорида натрия, В конце операции костный лоскут укладывают на место и фиксируют костными швами. С этой целью тонким бором накладываются отверстия в кости по обе стороны от распила, через которые проводится специальная проволока или прочные лигатуры.
В современной нейрохирургии все шире используются обширные базальные доступы с резекцией костей основания черепа. Такие доступы необходимы для удаления опухолей, располагающихся вблизи срединных, наиболее удаленных от поверхности структур мозга (опухоли парастволовой локализации, опухоли ската и пещеристого синуса, базальные аневризмы и др.). Широкая резекция костных структур основания черепа, включая крышу и латеральную стенку глазницы, крылья клиновидной кости, пирамиду височной кости и другие костные образования, позволяет подойти к наиболее глубоко расположенным патологическим очагам с минимальной тракцией мозга.
Для резекции костных структур вблизи крупных сосудов и черепных нервов применяются высокооборотные дрели и специальные фрезы с алмазным напылением.
В отдельных случаях для подхода к глубинным, срединно расположенным опухолям применяются лицевые доступы, доступы через придаточные пазухи: клиновидную, верхнечелюстные (гайморовы) и через рот.
Особое распространение получил трансназальный транссфеноидальный доступ к опухолям, развивающимся в полости турецкого седла, в первую очередь к опухолям гипофиза.
Техника операций на мозге
Исключительная функциональная значимость всего мозга и отдельных его структур делает необходимым использование такой хирургической техники, которая позволила бы выполнять операции с минимальным риском для больного. Эта задача становится выполнимой при использовании микрохирургической техники.
Положение больного. Для выполнения операций на отдельных структурах мозга используются различные положения больного на операционном столе: на спине иногда с головой, повернутой в сторону, на боку, в отдельных случаях больного оперируют в положении на животе с опущенной и согнутой головой, при операциях на задней черепной ямке широко используется положение больного сидя.
В каждом отдельном случае хирург определяет оптимальное положение больного для обнажения тех или иных участков мозга. При выборе положения больного необходимо учитывать возможное изменение гемодинамики (в первую очередь венозного кровообращения). Если больной во время операции находится в сидячем положении, то давление в венозных синусах головы резко снижается и может быть отрицательным. Этим феноменом объясняется возможное развитие воздушной эмболии – попадания воздуха в поврежденные крупные венозные коллекторы и скопление его в камерах сердца, при этом возникает опасность прекращения сердечной деятельности. Об этом осложнении надо помнить, когда больного оперируют в положении сидя, и применять ряд профилактических мер. Наиболее простым методом, позволяющим распознать ранение крупных вен, является компрессия яремных вен на шее. Если во время операции голова больного опущена вниз или вследствие ее резкого сгибания сдавливаются вены щей, венозное давление может резко повыситься, что приводит к увеличению объема мозга, его выбуханию в рану, избыточной кровоточивости. Продолжение операции в этом случае чревато серьезными осложнениями, и положение больного должно быть изменено.
Микрохирургическая техника. Основными компонентами микрохирургии является применение специальных бинокулярных луп и операционных микроскопов. В настоящее время при нейрохирургических операциях применяются операционные микроскопы, которые имеют следующие конструктивные особенности: мобильность, позволяющую свободно переметать микроскоп в различных, необходимых хирургу направлениях; меняющееся в широких пределах увеличение, хорошую освещенность операционного поля, наличие дополнительных окуляров для ассистента. Миниатюрная телевизионная камера, которой может быть оснащен микроскоп, позволяет ассистенту, операционной сестре и другим лицам, принимающим участие в операции (анестезиолог, нейрофизиолог и др.), видеть операционное поле на экране. Телевизионные и фотоприставки необходимы для получения документации об операции.
Применение микроскопа делает возможным проведение операции в узкой глубокой ране при минимальном смещении мозга. Дополнительные возможности при осмотре глубоко расположенных отделов мозга появляются при перемещении операционного стола и придании голове больного различных положений. С этой целью используются специальные столы и подголовники для фиксации головы больного.
Для выполнения операции под увеличением используются разнообразные микрохирургические инструменты: пинцеты, ножницы, диссекторы, миниатюрные зажимы для пережатия сосудов, шовный материал.
Мозговые ретракторы. Операции на мозге, особенно на его глубинных структурах, требуют смещения мозга (приподнимания, отодвигания) нередко на длительный период времени. Для достижения этого используются специальные автоматические ретракторы, которые могут удерживать мозг в различных, нужных для хирурга положениях. Эти ретракторы прикрепляются либо к краю трепанационного отверстия, либо к специальным рамам, фиксирующимся к столу и голове больного. При пользовании шпателями хирург всегда должен помнить о том, что резкое смещение и сдавленно мозга приводит к так называемой ретракционной ишемии, повреждению мозговой ткани и ее сосудов (особенно вен) и опасности внутримозгового кровотечения в послеоперационном периоде. Тракция мозга должна быть минимальной, положение шпателей в течение операции надо постоянно менять.
Защита мозга от высыхания. С этой целью обнаженную поверхность мозга закрывают ватниками, смоченными изотоническим раствором хлорида натрия. При длительных операциях ватники необходимо менять и смачивать, чтобы они не присыхали к коре мозга.
Методы остановки кровотечения. Мозг, один из наиболее кровоснабжаемых органов, пронизан массой сосудов. Остановка кровотечения из ткани мозга отличается существенной спецификой, так как в узкой и глубокой ране перевязка сосудов, широко принятая в общей хирургии, практически невозможна. В ряде случаев для остановки кровотечения из крупных сосудов мозга применяются специальные миниатюрные зажимы клипсы. Однако наиболее распространенным способом остановки кровотечения является коагуляция (моно– и биполярная). Особое значение имеет точечная биполярная коагуляция, при которой ток циркулирует только между кончиками пинцета и нет прогревания соседних структур, что крайне важно при операциях на мозге, особенно на его глубоко расположенных структурах.
Для остановки паренхиматозного кровотечения из ткани мозга широко применяется специальная кровоостанавливающая фибриновая губка, гемостатическая марля, биологический клей (тиссукол) и ряд других препаратов, вызывающих коагуляцию крови и формирование прочного кровяного сгустка. Наряду с этими средствами широко используются промывание раны изотоническим раствором хлорида натрия и тампоны, смоченные перекисью водорода.
Кровотечение из поврежденных крупных сосудов и венозных синусов может быть остановлено также путем тампонады кусочком размятой мышцы.
Методы интраоперационной диагностики. Для ориентировки в операционной ране и обнаружения образований, расположенных в глубине мозга, нередко возникает необходимость в использовании специальных приемов и дополнительных диагностических методов.
Пункция мозга. Наиболее часто применяемым методом, позволяющим хирургу обнаружить расположенное в глубине мозга патологическое образование (опухоль, абсцесс, гематома), является пункция. Для этого используются специальные мозговые канюли с тупым концом и боковым отверстием. По изменению сопротивления, которое испытывает хирург, погружая канюлю в мозг, он может определить край опухоли, стенку абсцесса, кисты. Поступление через канюлю кистозной жидкости, крови, гноя дает хирургу дополнительную информацию и позволяет определить дальнейший план операции.
Для обнаружения во время операции глубоко расположенных опухолей могут быть использованы специальные радиосцинтилляционные зонды, позволяющие определить области накопления радиоактивного изотопа. Для этой цели до операции больному внутривенно вводится препарат изотопа (радиоактивного фосфора, ртути), который избирательно накапливается в опухоли. О попадании зонда в опухолевую ткань свидетельствуют изменение показаний радиосцинтиляционного счетчика и соответствующая звуковая индикация.
Ультразвуковая локация мозга. В последнее время для обнаружения образований, расположенных в глубине мозга, используется ультразвуковая локация. После трепанации черепа на невскрытую твердую мозговую оболочку или обнаженную поверхность мозга устанавливается ультразвуковой датчик, изменяя положение которого можно получить на экране изображение глубоких структур (желудочки, серп большого мозга) и расположенного в толще мозга новообразования (опухоль, гематома, абсцесс).
Хирургические аспираторы. Одна из характерных особенностей операций на мозге состоит в том, что хирург постоянно должен удалять цереброспинальную жидкость, поступающую в большом количестве из желудочков мозга и субарахноидальных пространств. Применение специальных аспираторов существенно упрощает эту задачу. Отсосы, которыми пользуется нейрохирург, одновременно являются важным инструментом, с помощью которого может выполняться препаровка тканей. Чтобы не вызвать повреждения мозга, не ранить сосуды, необходимо, чтобы кончик отсоса был закругленным, без острых краев. В зависимости от ситуации используются отсосы разного диаметра и разной конфигурации.
Ультразвуковые отсосы. Важным изобретением последних лет являются ультразвуковые отсосы, с помощью которых одновременно можно разрушать патологическую ткань (опухоль) и аспирировать ее, а также удалять цереброспинальную жидкость.
Для рассечения мозговой ткани, остановки кровотечения, выпаривания патологической ткани при выполнении нейрохирургических операций используются лазерные установки, совмещенные с операционным микроскопом (аргоновые, неодимовые), и др.
Виды нейрохирургических операций
В зависимости от цели операции на головном мозге могут быть условно разделены на радикальные и паллиативные вмешательства. Цель радикальных операций состоит в удалении патологических образований (гематома, абсцесс, опухоль), восстановлении нормальных анатомических взаимоотношений (реконструкция) при травматических переломах черепа, уродствах и т.д. Понятие «радикальное вмешательство» применяется с определенной оговоркой. Оно определяет цель операции, но результат ее не всегда соответствует поставленной задаче (например, при опухоли мозга часто не удается добиться ее радикального удаления).
Паллиативные операции не ставят целью избавить больного от самого заболевания, а направлены на облегчение состояния больного. Примером паллиативной операции является создание новых путей оттока цереброспинальной жидкости из желудочков мозга при неоперабельных опухолях, приводящих к окклюзии ликворных путей и нарушению ликвороциркуляции (вентрикуло атриальное или вентрикуло перитонеальное шунтирование).
В зависимости от срочности операции нейрохирургические вмешательства подразделяются на плановые и экстренные (ургентные) . Экстренные операции обычно делаются по жизненным показаниям. Необходимость в безотлагательных операциях возникает при травматических гематомах, при острой окклюзии ликворных путей, при развитии у больного симптомов дислокации мозга и сдавления его стволовых отделов в большом затылочном или тенториальных отверстиях.
Стереотаксические операции. Наряду с открытыми операциями на мозге, требующими выполнения трепанации черепа, применяются и так называемые Стереотаксические (от греч. stereos – объемный, пространственный и греч. taxis – расположение) вмешательства, осуществляемые через небольшое фрезевое отверстие.
Суть стереотаксических операций заключается в том, что в точно заданные отделы мозга (обычно глубоко расположенные) вводятся различные инструменты: электроды для разрушения и стимуляции мозговых структур, канюли для криодеструкции, инструменты для биопсии или разрушения глубоко расположенных опухолей.
Упомянутые инструменты вводятся в мозг с помощью специальных стереотаксических аппаратов, фиксируемых на голове больного. В этих аппаратах имеются устройства, позволяющие пространственно ориентировать вводимый в мозг инструмент и определять глубину его погружения.
Для определения координат мишеней (подкорковые ганглии, ядра таламуса, среднего мозга и другие глубинно расположенные структуры мозга, а также глубинно расположенные опухоли, гематомы, абсцессы и др.) используются специальные Стереотаксические атласы и данные компьютерно томографического и магнитно резонансного исследований.
Современные Стереотаксические приборы позволяют вводить в мозговые структуры необходимые инструменты с точностью до 1 мм.
Стереотаксические операции нашли особенно широкое применение в функциональной нейрохирургии (лечение гиперкинезов, болевых синдромов, эпилепсии и др.).
Метод пространственной ориентации во время операции на головном мозге в последнее время стал возможен и без использования стереотаксических аппаратов.
В этом случае на экране дисплея хирург может воспроизвести любые срезы мозга, полученные ранее с помощью компьютерной и магнитно резонансной томографии, и определить на них положение инструментов, которыми он пользуется (пинцет, отсос и т.д.), что достигается путем локации этих инструментов с помощью инфракрасных или других лучей.
Эндоскопические операции. Как и в других разделах хирургии, в нейрохирургии последних лет достаточно широко стали применяться эндоскопические вмешательства. В основном эти операции производятся на желудочках мозга. Применяются жесткие и гибкие эндоскопы, снабженные инструментами для забора ткани, ее разрушения и остановки кровотечения (с помощью коагуляции или воздействия лазером).
Введение эндоскопов может осуществляться с помощью стереотаксических аппаратов.
Радиохирургические вмешательства. Принцип пространственного ориентирования, лежащий в основе стереотаксических операций, используется также и для строго сфокусированного лучевого воздействия на мозг.
С этой целью используются специальные радиохирургические установки, лучшей из которой является гамма нож, разработанный известным шведским нейрохирургом А. Лекселлом. Гамма нож имеет вид громадного шлема, в который монтируется около 200 точечных источников гамма лучей. Излучение всех источников фокусируется в одной точке. Положение головы больного по отношению к шлему и коллимация излучения позволяют получать зону воздействия строгой геометрической формы, что дает возможность направленно разрушать глубоко расположенные опухоли, практически избегая опасного облучения рядом расположенных тканей.
По точности такое воздействие равнозначно хирургическому вмешательству, что оправдывает название такого лучевого лечения – «радиохирургия». Близкие результаты могут быть получены при использовании строго сфокусированного пучка протонов, электронов и некоторых других видов высокой энергии.
Эндовазальные вмешательства. При ряде сосудистых заболеваний мозга применяется так называемый эндовазальный метод лечения. Он заключается в том, что под рентгенологическим контролем в сосудистое русло вводят специальные катетеры, которые позволяют доставлять к пораженному сосуду специальные окклюзирующие устройства: миниатюрные баллончики, заполняемые латексом, спирали, вызывающие тромбообразование в просвете сосуда, и некоторые другие.
Как правило, такие операции проводятся под местной анестезией. Катетеризируется бедренная или сонная артерия. Операции переносятся больными легче, чем открытые операции на сосудах мозга, проводящиеся под наркозом и требующие сложных хирургических доступов. Эндовазальные операции применяются для «выключения» некоторых видов аневризм и соустий сосудов головного мозга.